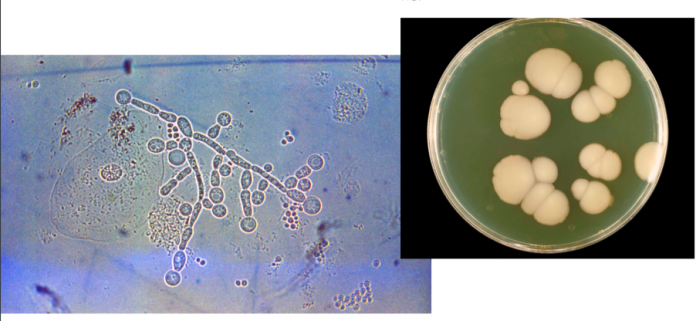
Introducción
La candidiasis es una infección fúngica (micosis) de cualquiera de las especies de Candida. Las vulvovaginitis a repetición son un problema común en la práctica clínica. La Candidiasis Vulvovaginal (CVV) es la segunda causa más frecuente de infecciones en el tracto genital.
Candida es ubicua en la naturaleza, y es comensal humana y patógeno oportunista. Los reservorios son la boca, el intestino, la piel y la vagina. Las defensas del organismo frente a ellas son: la microbiota vagina, fundamentalmente los lactobacilos, la IgA y la IgG, en la vagina y en la circulación general, y los linfocitos T en la superficie vaginal.
La CVV es una infección vaginal causada principalmente por Candida albicans, muy común en las mujeres adultas (puede aislarse en la cavidad vaginal de entre un 2% y más de un 40% de las mujeres sanas asintomáticas), con un pico máximo de incidencia entre los 20 y 40 años. También puede estar causada por otras especies de Candida no-albicans como Candida glabrata, C. tropicalis, C. krusei y con menor frecuencia, C. kephyr, C. guillermondii u otras.
La CVV afecta hasta al 75% de las mujeres en edad fértil una vez en su vida, y se estima que hasta el 5% de las mujeres con CVV experimentan 4 o más episodios por año, lo que se define como candidiasis vulvovaginal recurrente (CVVR).
Actualmente, se considera que la recidiva se produce por una alteración de la microbiota vaginal, con persistencia de las levaduras en la vagina o microorganismos más resistentes o más virulentos, o por un fallo de la defensa vaginal, más que por una reinfección vaginal (por el tracto gastrointestinal o por transmisión sexual), teoría corroborada por el aislamiento de formas con idéntico cariotipo en las recurrencias. Clínicamente suelen presentarse con menor inflamación vulvovaginal, caracterizándose más por molestias locales que se exacerban los días previos a la menstruación. Los síntomas más comunes son prurito, flujo vaginal abundante, disuria, ardor y sensación urente.
C. albicans se reproduce en ambiente aerobio o microaerófilo por gemación originando células hijas o blastoconidios. Entre los factores de patogenicidad propios de esta especie se encuentran: su termotolerancia y excelente desarrollo a 37°C, la propiedad de adherirse a receptores de células epiteliales de la vagina mediante proteínas (adhesinas) y su capacidad para producir gemaciones alargadas o seudohifas, con mayor poder invasivo. También presentan proteinasas ácidas, lipasas y aspartil proteasas, que favorecen su poder invasivo y la protegen de la fagocitosis. Hay diversos componentes proteicos de C. albicans que actúan como antígenos produciendo fenómenos de hipersensibilidad inmediata, mediada por IgE y demorada mediada por células.
Factores de riesgo asociados con la susceptibilidad CVVR
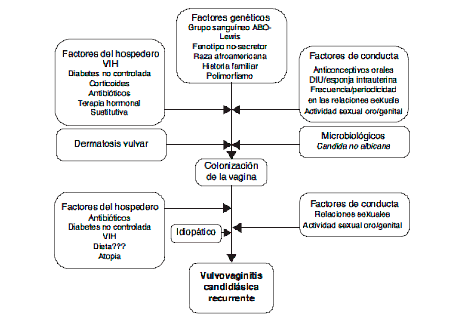
La CVV se considera un trastorno multifactorial, donde una composición desequilibrada de la microbiota vaginal, la genética y factores predisponentes del huésped, así como las cepas de Candida probablemente favorecerán el inicio de la enfermedad.
El microbioma vaginal está habitualmente habitado tanto por comunidades bacterianas, principalmente representadas por el género Lactobacillus, y sus contrapartes de levadura, comúnmente llamadas micobiomas. Las especies de Candida son los organismos fúngicos más abundantes del micobioma vaginal; por lo tanto, pueden ser agentes causantes de infecciones vaginales en algunas condiciones. Las especies de Lactobacilos se cree que favorecen un microbioma vaginal sano tanto acidificando el medio ambiente a través del metabolismo anaeróbico de glucógeno a ácido D-láctico como a través de la producción de peróxido de hidrógeno, cuya actividad antimicrobiana es probable que inhiben la invasión de Candida.
Varios factores pueden alterar la microbiota vaginal en pacientes con CVVR: los cambios en la comunidad de Lactobacillus productores de peroxido asi como una condición de estrógenos altos (es decir, terapia de reemplazo de estrógenos, anticonceptivos orales, fase lútea o embarazo). Se ha demostrado que estas condiciones alteran el equilibrio entre la tolerancia y la invasión, lo que lleva a la adhesión de Candida al epitelio de la mucosa, el crecimiento anormal de la levadura y un mayor riesgo de contraer infecciones de Candida. Además, se han sugerido un amplio espectro de factores predisponentes relacionados con el huésped, tales como diabetes mellitus tipo 2, inmunosupresión, terapia con antibióticos, así como factores conductuales como son el uso de anticonceptivos y dispositivos intrauterinos para promover la aparición de CVV. También se ha hipotetizado que las diferencias interindividuales, como el origen genético y el origen étnico, así como los tipos de cepas de Candida y su ocurrencia, podrían desempeñar un papel clave en la patogénesis idiopática del CVVR.
Sin embargo, alrededor del 20-30 % de mujeres con candidiasis vulvovaginal recurrente (CVVR) no presentan factores de riesgo reconocibles. El uso de agentes antifungicos es usualmente efectivo en el tratamiento de esta condición aliviando los síntomas asociados al disconfort. Sin embargo, en un 5% de estas mujeres, la vulvovaginitis reaparece luego de la finalización del tratamiento.
Patogenia de las CVVR
Aunque se cree que las causas predisponentes mencionadas anteriormente explican algunos casos de CVV en todo el mundo, queda por dilucidar qué contribuye al cambio de CVV a CVVR. Por lo tanto, se ha planteado la hipótesis de que una desregulación inmunológica por parte del huésped podría explicar la mayoría de los episodios, aunque aún no se ha aclarado si puede deberse a una respuesta deficiente o hipersensible del sistema inmunitario del huésped
Inmunología de la vagina humana
La vagina humana consta de múltiples niveles de protección que involucran componentes de la inmunidad innata y adaptativa, y se encuentra bajo un fuerte control hormonal, dado que muchos procesos fisiológicos que incluyen la menstruación, la concepción, el embarazo y los cambios hormonales frecuentemente modulan el sistema inmunitario de la mucosa vaginal.
La mucosa vaginal contiene macrófagos, células de Langerhans, eosinófilos, linfocitos, mastocitos y plasmocitos (productores de IgG e IgA) que acceden rápidamente al lumen, lo que demuestra que la vagina es capaz de montar una respuesta inmune. El revestimiento de la mucosa y las células epiteliales evitan la entrada de patógenos en la vagina. Las células epiteliales de la mucosa además de atrapar los patógenos invasivos, mediante la producción de mucinas proporcionan lubricación y actúa como fuente de nutrición para la microbiota vaginal. A su vez, la microbiota de mujeres sanas (dominada por Lactobacilli) contribuye a la defensa física de la mucosa vaginal contra los patógenos al mantener un pH bajo, producir ácido láctico y otras sustancias antimicrobianas.
En cuanto a la inmunidad adaptativa del tracto reproductivo femenino, diferentes estudios han documentado una débil pero constante respuesta de anticuerpos IgG e IgA en las secreciones vaginales, siendo la primera más predominante que la segunda. Estos anticuerpos evitan la colonización del patógeno al verificar su adherencia a las células epiteliales vaginales y contribuyen a la neutralización y la formación de complejos antígeno-anticuerpo, ayudando a la absorción y eliminación del patógeno por las células fagocíticas de la vagina. Los linfocitos T se localizan en bajo número en la interfaz estroma / epitelial del tejido vaginal. Además, también se ha reportado la presencia de células T-helper 17 (Th17) y células T reguladoras (Treg) en la vagina. Sin embargo, durante la inflamación, el número de población de linfocitos intraepiteliales aumenta en relación con la vagina no inflamada.
Inmunología de la CVVR
En cuanto a la alteración inmunológica como origen de la CVVR, existe la posibilidad de que una respuesta inmunológica excesiva o escasa se encuentre como base en estos cuadros recurrentes. Por un lado se ha descrito una deficiencia específica frente a la Candida, la llamada «tolerancia inmunológica de la vagina frente a la Candida», que le permitiría germinar y proliferar de forma incontrolada. Sin embargo, también se ha argumentado que podría haber «una respuesta inmunológica exacerbada frente a la cándida», que involucraría tanto mecanismos de inmunidad mediada por IgE como mediada por células.
Candidiasis Vulvovaginal Recurrente Alérgica
Numerosos estudios han demostrado que la respuesta inmune vaginal puede en algunas ocasiones causar vaginitis recurrente. Se ha identificado en flujo vaginal de mujeres con vaginitis recurrente anticuerpos IgE anti C. albicans, anti componentes del semen, polen y espermicidas. Además también se ha descripto la presencia de prostagandina E2 y la detección de eosinófilos en lavado cervico-vaginal.
La exposición de alérgenos en el lumen vaginal es seguida por el transporte de estas a través de los canales interepiteliales y su interacción con IgE especifica unida a mastocitos, lo que desencadena la degranulación de estas células y la liberación de histamina y otros mediadores inflamatorios, causando síntomas de vaginitis alérgica. En adición, la histamina actúa como un potente inductor de PG E2 en macrófagos suprimiendo la respuesta inmune celular, la cual es necesaria para la protección contra los hongos. Así la candidiasis vulvovaginal sintomática podría ser una consecuencia secundaria de una vaginitis primaria alérgica.
La mucosa vaginal humana tiene algunas particularidades con respecto a la sangre que pueden influenciar la concentración de varios tipos de sustancias que facilitarían el desarrollo de alergias sistémicas y locales. La ruta de sensibilización vaginal puede ser por contacto directo o indirecto con manos, dedos, ropa, durante la interacción sexual y posterior a la ingestión de alimentos o drogas y/o inhalación. El hecho de que la mucosa vulvar no esté queratinizada y la humedad en la que se encuentra inmersa, pueden favorecer la penetración de agentes irritantes y alérgenos como ácaros, semen, látex presente en los guantes, preservativos y diafragmas, C. albicans, parásitos (Enterobious vermicularis), espermicidas, medicación tópica (antibióticos, antifúngicos y anestésicos locales), esmalte de uñas y productos de higiene íntima. Como factores favorecedores se consideran las relaciones sexuales frecuentes, la diátesis atópica y la higiene excesiva, entre otros.
La secreción de hormonas es influenciada por factores inmunológicos y viceversa. Hay un mecanismo de regulación de la inmunidad de la mucosa vaginal en el tracto reproductor femenino durante el ciclo menstrual. : (1) Menstruación, (2) fase preovulatoria (proliferativa), con predominio de estrógenos, (3) fase periovulatoria, cuando ambos estrógenos y progesterona son activos, y (4) fase post ovulatoria, con predominio de progesterona que permanece hasta la próxima menstruación. Durante la menstruación y en la fase periovulatoria se produce una atenuación de la vigilancia inmunológica normal y una mayor susceptibilidad a las infecciones y reacciones alérgicas. La inmunosupresión también puede ser un mecanismo para atenuar la respuesta inmunitaria de la mujer a los espermatozoides. En modelos murinos de experimentación, se ha demostrado que la vagina es un sitio inductivo para la respuesta inmune de la mucosa, donde se observa disminuida la presentación antigenica en el periodo que coincide con la ovulación y el depósito intravaginal de esperma.
Algunos estudios muestran que la progesterona favorece el desarrollo de células T-ayudantes que producen citocinas de tipo Th2 que son responsables de las reacciones de hipersensibilidad mediadas por IgE. La respuesta inmune a C. albicans y, por lo tanto, la capacidad de este organismo para proliferar y experimentar la transición asintomática de la levadura al tubo germinal está influenciada por altos niveles de progesterona. Los cambios endocrinos regulan los niveles de IgA e IgG en las secreciones uterinas y vaginales. Todo lo expuesto explica el hecho de que la incidencia de reacciones alérgicas y vaginitis por Candida es más común en la fase luteal tardía, justo antes de la menstruación.
Hay evidencia que incrimina a C. albicans como un potente alergeno. Tanto las fracciones de proteínas como de carbohidratos de la levadura contienen alérgenos. Así, la IgE contra C. albicans asociada con una prueba cutánea positiva inmediata, prueba de provocación y síntomas clínicos de alergia ya se han demostrado en las mucosas de los pulmones, la nariz y la piel. Witkin y colab., identificaron IgE específica reactiva a C. albicans, polen, espermicidas y fluido seminal en lavados vaginales de mujeres con vaginitis recurrente resistente al tratamiento convencional para Candida pero no en sus sueros. Estos datos sugieren que hay dos tipos de vaginitis alérgica por Candida recurrente: (1) principalmente debido a la hipersensibilidad a la Candida y (2) secundaria a otros tipos de alergia vaginal, como el polen, el semen y el látex. La inmunoterapia contra C. albicans durante un año en mujeres con CVV alérgica y una prueba prick test positiva a C. albicans demostró una disminución significativa del número medio de episodios de vaginitis. En este sentido, algunas publicaciones demuestran una fuerte correlación entre atopia y CVVR: muchas de las pacientes con CVVR padecen atopia y hasta el 70% rinitis alérgica. Más aun, algunas mujeres con CVVR desarrollan hipersensibilidad local a Candida y mejoran clínicamente con inmunoterapia alérgica con extracto de C. albicans o tratamiento con zafirlukast y cetirizina, que inducen remisión y muchas veces son consideradas como terapias de mantenimiento en pacientes que fallan para resolver los síntomas con los tratamientos antifungicos convencionales.
Inmunidad celular y CVVR
El papel de la hipersensibilidad tardía también se ha explorado en modelos de candidiasis vaginal murina, donde las cepas de ratones que exhiben predominantemente una respuesta inmune de las células auxiliares de linfocitos Th1 son resistentes a la candidiasis vulvovaginal, mientras que las cepas que producen predominantemente mayores cantidades de la citocinas IL-4 del perfil Th2 eran más propensas a las infecciones recurrentes por levaduras. Así, un defecto en la inmunidad Th1 trae como consecuencia infecciones fúngicas recurrentes. Además, las mutaciones que afectan el eje Th17/IL-17 aumentan la susceptibilidad a infecciones por hongos. Dado que la inmunidad mediada por células tiene un rol en el desarrollo, diagnóstico y tratamiento de la CVVR se recomienda evaluar los linfocitos T en sangre periférica como en el microambiente de la mucosa vaginal.
Diagnóstico diferencial de la CVVR
Los síntomas de CVV incluyen prurito, descenso vaginal, dolor vaginal, dispareunia y disuria externa. En el diagnóstico diferencial de la CVVR, se debe considerar el tratamiento inadecuado de una CVV debido a terapia inefectiva, duración insuficiente de la terapia y/o interacciones con otras drogas, que disminuyan el nivel de la droga administrada; otras infecciones (tricomoniasis, vaginitis bacteriana, Herpes simplex genital, papiloma virus, VIH), dermatitis de contacto, vaginitis atrófica, hipersensibilidad demorada, alergia, síndrome de Behcet, pénfigo, etc.
El diagnóstico de candidiasis se puede hacer mediante inspección visual, determinación del pH vaginal, microscopía y cultivo de secreción cervicovaginal.
Primeramente debe descartarse la vulvovaginitis infecciosa, esto se realiza mediante el cultivo micológico del exudado vaginal, en medios apropiados. Debido al creciente número de infecciones por Candidas no albicans, posiblemente debido a la utilización masiva de azólicos en forma empírica con la consiguiente emergencia de resistencia a los mismos, además de las cepas que tienen resistencia natural como C. krusei, se vuelve muy importante la identificación a nivel de especie, lo cual puede realizarse rápidamente y en forma precisa utilizando métodos automatizados. Además es recomendable un estudio de sensibilidad a antifúngicos (antimicograma) para completar el estudio y así orientar a un tratamiento eficaz.
Una vez excluidas enfermedades sistémicas y/o descartados otros patógenos causantes de vaginitis, se debe evaluar historia de atopia como así también otros síntomas de la enfermedad alérgica a cándida en otros órganos, como rinitis, asma y conjuntivitis. Se aconseja valorar hipersensibilidad a cándida mediante test cutáneos para Candida albicans, hongos totales y/o otros alérgenos relacionados (hipersensibilidad tipo I) y test a candidina (hipersensibilidad tipo IV).
Aporte del laboratorio de inmunología al diagnóstico de CVVR
Desde el laboratorio de inmunología, además de evaluar la presencia de inmunodeficiencias humorales y/o celulares mediante el dosaje de inmunoglobulinas séricas, poblaciones linfocitarias en sangre periférica y IgE sérica total y especifica frente a Candida albicans, se aconseja estudiar las poblaciones inmunes y el ambiente del tracto genital femenino (TGF). Mediante la realización de lavados cervicovaginales (LCV) se evalua IgA, IgG e IgE total e IgE específica para Candida y recuento de eosinofilos mientras que para estudiar las poblaciones inmunes del TGF se cuantifican las subpoblaciones linfocitarias T en una muestra de células mononucleares obtenida mediante cepillado cervical durante la fase post ovulatoria del ciclo menstrual considerando tanto si hay infección activa como si la paciente está en un periodo de intercrisis.
Conclusiones
Candida albicans es un potente alergeno en algunas situaciones y se ha sugerido que la hipersensibilidad local a esta levadura puede ser un factor en la prolongación de la enfermedad.Todo lo expuesto, sugiere que las pacientes con CVVR podrían tener un defecto pre-existente en la inmunidad celular o antecedentes de alergia, lo que podría aumentar la susceptibilidad de la mucosa a la infección por Candida. Los mecanismos subyacentes de la hipersensibilidad vulvovaginal crónica por Candida y la respuesta a la inmunoterapia son complejos y no son totalmente comprendidos. Tanto la respuesta inmune innata como la adaptativa serían necesarias para proteger al huésped del crecimiento sistémico excesivo de C. albicans. Así, un delicado balance entre las respuestas Th1, Th17 y Th2 y otros mediadores biactivos como las prostaglandinas prevengan la CVVR y la subsecuente reacciones de hipersensibilidad.
Autora: Dra. Romina Ranocchia – Área Inmunología- Autoinmunidad- Serología de Fares Taie Instituto de Análisis
Bibliografía
- Allergic vulvovaginitis. Taketomi E et al. Annals of Allergy, Asthma, & Immunology, 2000; 85:253-267
- Genital contact allergy: A diagnosis missed. Smriti N et al. Indian J Sex Transm Dis AIDS. 2016 Jan-Jun; 37(1): 1–6.
- Candida albicans allergen immunotherapy in recurrent vaginal candidiasis. Taketomi E. A J Investig Allergol Clin Immunol. 2000; 10(5):305-309.
- Recurrent Vulvovaginal Candidiasis: Could It Be Related to Cell-Mediated Immunity Defect in Response to Candida Antigen? Sherkat R et al. Int J Fertil Steril. 2017; 11(3): 134-141.
- Chronic vulvovaginal Candida hypersensitivity: An underrecognized and undertreated disorder by allergists. Seidu, L. Allergy Rhinol 6:e44 –e49, 2015
- Infecciones Recurrentes, Candidiasis Vaginal. Antonio Guillermo Báez