¿Que son los anticuerpos antinucleares (ANA)?
Son un grupo variado de autoanticuerpos que se unen a componentes macromoleculares de los núcleos celulares. La presencia de los mismos en el suero indica la existencia de una respuesta inmunológica, pero no necesariamente de una enfermedad. El hallazgo de ANA positivo es común en muchas enfermedades autoinmunes, pero también pueden aparecer en individuos sanos, en enfermedades de otro origen, con el uso de algunos fármacos, en tumores o en infecciones.
La primera referencia histórica de ANA son las células LE descriptas por Hargraves en 1948, cuando, en una punción de médula ósea, observaron la presencia de fagocitosis de material nuclear intacto opsonizado por autoanticuerpos. El factor responsable del fenómeno de células LE resultó ser una familia de autoanticuerpos que reconocía diferentes constituyentes nucleares. Actualmente el pedido de células LE está en desuso y fue reemplazado por el pedido de ANA.
Historicamente estos anticuerpos se han denominado FAN (factor anti núcleo) o ANA (del inglés, Anti- Nuclear Antibodies) y se interpretan como anticuerpos dirigidos contra antígenos exclusivamente nucleares, dejando fuera los anticuerpos dirigidos contra antígenos citoplasmáticos u otras estructuras celulares, como aparato mitótico o aparato de Golgi, por lo que se ha propuesto recientemente, en el primer consenso argentino, que la denominación correcta seria anticuerpos antinucleocitoplasmaticos.
¿Cuándo deben solicitarse los ANA?
La solicitud de los ANA estará indicada en toda aquella situación clínica en la que se sospecha la existencia de enfermedad autoinmune subyacente. En el caso de que los ANA sean positivos, se solicitarán más anticuerpos según la sospecha clínica. Los ANA son poco útiles en ausencia de signos o síntomas de conectivopatía. Además son poco específicos, ya que pueden asociarse al uso de algunos fármacos (Lupus inducido por drogas) o enfermedades de otro origen como tumores o infecciones.
Los ANA son útiles cuando las manifestaciones clínicas son sugerentes de enfermedad autoinmune como Lupus Eritematoso Sistémico (LES), Síndrome de Sjögren (SS), Polimiosistis/Dermatomiositis, Lupus asociados a drogas y hepatitis autoinmune. Su presencia no se relaciona con un espectro clínico determinado, salvo en la artritis idiopática juvenil, en donde sirve como monitoreo y pronósticos para estratificar los riesgos de uveítis. Tampoco tienen un significado específico, si bien títulos elevados hacen más probable la presencia de enfermedad autoinmune, en especial en el LES.
¿En que enfermedades aparecen los ANA positivos?
La presencia de ANA es el denominador común de muchas enfermedades autoinmunes sistémicas con relevancia clínica demostrada. La frecuencia es especialmente alta en LES, Síndrome de Sjögren Esclerodermia, Enfermedad Mixta del Tejido Conectivo ,Polimiosistis /Dermatomiositis, Lupus inducido por drogas y hepatopatías autoinmunes, entre otras. Muy útil en el monitoreo y pronóstico de artritis crónica juvenil (para estratificar riesgo de uveítis).
Su presencia en las distintas patologías tiene valor diagnóstico, pronóstico y de monitoreo, sin embargo, estos autoanticuerpos también están presentes en infecciones, enfermedades malignas y tiroideas y aun en individuos sanos (particularmente en mujeres mayores de 40 años y en ancianos).
¿Puede haber enfermedades autoinmunes con ANA negativos? ¿En qué casos se debe solicitar anticuerpos específicos con ANA negativos?
Hay enfermedades sistémicas autoinmunes que cursan con ANA negativos, por eso los síntomas y la exclusión de otros fenómenos son claves para el diagnóstico.
Si el grado de sospecha de conectivopatía es bajo, se puede dar por finalizado el estudio y valorar otros diagnósticos. En el caso de ANA negativos, pero con alta sospecha de conectivopatía, se procederá a tratar de identificar específicamente los diferentes autoanticuerpos englobados dentro de los ANA, por ejemplo, hay que investigar la presencia de anti-SSA/Ro ya que este antígeno se disuelve con los fijadores improntas de HEP2.Otros de los anticuerpos a estudiar con alta sospecha clínica y ANA negativo son: anti-ribosomal P y anti-Jo-1 por ELISA u otro método específico.
Se debe tener en cuenta que el resultado negativo no implica ausencia de enfermedad. Estos pueden observarse en pacientes con síndrome de Sjögren, Polimiositis, Artritis reumatoidea, esclerodermia y en un subgrupo de pacientes con LES considerados ANA negativos – SSA/Ro positivos con características clínicas particulares.
¿Tiene importancia que se informe el titulo?
El título tiene importancia diagnóstica, ya que el valor predictivo positivo aumenta a títulos elevados. En un esfuerzo por reducir el número de falsos positivos o resultados clínicamente irrelevantes, los laboratorios comenzaron a informar los títulos. En general, los pacientes con LES presentaban títulos mucho más altos (>1/160) que los individuos normales o con otras enfermedades.
La prueba de ANA positiva fue incorporada como uno de los criterios diagnósticos de LES por el Colegio Americano de Reumatología. Para evitar resultados falsos positivos o falsos negativos, los laboratorios deben ajustar perfectamente sus condiciones de trabajo para interpretar los resultados correctamente, en especial buscando la dilución de corte que permita discernir mejor entre los individuos sanos y los enfermos.
Las variaciones en los títulos de ANA no están directamente relacionados con las variaciones en la actividad de la enfermedad, a excepción de los títulos de anti-DNA, cuya elevación se relaciona con la actividad lúpica y un mayor riesgo de nefropatía.
¿Cuál sería el valor de corte de ANA en individuos sanos?
En distintos trabajos y guías se comunican los porcentajes de positividad obtenidos en individuos sanos, siendo entre 25-30% para títulos de 1/40; 10-15% para 1/80 y 5% para títulos de 1/160. En familiares sanos de pacientes con enfermedades autoinmunes suelen reportarse títulos mayores de 1/40 en un 25-30% de los casos. Esto demuestra el gran significado que tiene establecer un título de corte en el laboratorio o bien utilizar un valor determinado en una población y bajo condiciones de trabajo semejantes a las nuestras. Una guía de Medicina Basada en la Evidencia para el uso de ANA recomienda informar junto al título positivo el porcentaje de individuos sanos que presentan el mismo título.
La determinación de ANA debe informarse de manera dicotómica (positivo o negativo). El resultado positivo debe ser acompañado por el título y el patrón.
La frecuencia de ANA en la población general varía en función de la edad y del sustrato antigénico utilizado, ya que el número de resultados positivos aumenta con la edad y es mayor en la IFI sobre células de HEP-2.
¿Los patrones hallados se asocian a unos anticuerpos específicos?
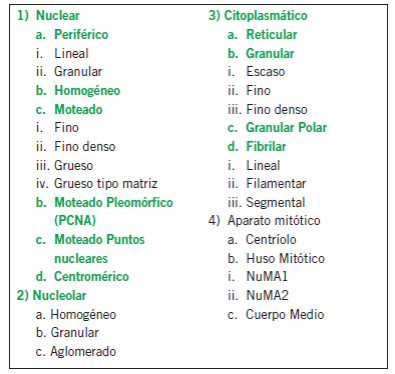
Los principales patrones que se distinguen por IFI son homogéneo, moteado, centromérico, nucleolar, y patrones citoplasmáticos (como reticular, actina, etc).
El patrón observado orienta hacia que anticuerpos especificos analizar. El único patrón que se asocia a una patología es el patrón centrómerico y se asocia con la Esclerodermia Limitada. El patrón nucleolar es frecuente en los pacientes con Esclerodermia Sistémica (ES), pero puede verse en el LES y en el síndrome de Sjögren. Los títulos elevados de ANA con patrón homogéneo o periférico sugieren el diagnóstico de LES.
¿Puede existir ANA positivos con ENA (antígenos nucleares extraíbles) negativos?
El término ENA (antígeno nuclear extraíble) incluye Sm, RNP, Ro (60 y 52 kd), La, Jo-1. Existe una relación entre los patrones observados por IFI y los anti ENA aunque no absoluta ya que por IFI alcánzamos a detectar 100 o 150 antígenos y en los ENA estamos detectando 7 u 8 antígenos.
El patrón homogéneo se asocia con anti DNA e histonas (lupus inducido por drogas). El patrón moteado se asocia con u1RNP, Sm, Ro y La. El patrón centrómerico se asocia a CENP-B. El patrón nucleolar se asocia con Pm/Scl y Scl70. El patrón citoplasmático moteado se asocia a anti mitocondriales (AMA) asociado a cirrosis biliar primaria (CBP) o Jo-1 en Polimiositis, si el moteado es difuso de asocia a Rib P.
¿Que tener en cuenta para interpretar correctamente los ANA?
Hay que tener en cuenta que la correcta interpretación de los resultados requiere considerar:
- La edad y el género del paciente.
- El uso de drogas que provoquen LES inducido, como por ejemplo: Hidralazina.
- El título obtenido.
- El patrón inmunofluorescente. Estos patrones pueden cambiar cuando se leen a diferentes diluciones. Debe ser informada la presencia de más de un patrón con sus respectivos títulos.
- Tener en cuenta los criterios diagnósticos de enfermedades autoinmunes sistémicas.
- La posibilidad de la presencia de autoanticuerpos como fenómenos paraneoplásicos, como puede ocurrir en el cáncer de mama.
- La posibilidad de la presencia de enfermedades infecciosas, como, por ejemplo, suele ocurrir en la lepra o pacientes HIV positivos.
- La posibilidad de tener resultados positivos en pacientes sanos y en personas con edad avanzada.
¿Cuál es el método de referencia, para evaluar los ANA? ¿ y cuál es el mejor sustrato?
La técnica de referencia es la inmunofluorescencia indirecta (IFI). Al final de la década del 50 se desarrolló la técnica de IFI empleando como sustratos cortes criostáticos de tejidos (hígado y riñón) de roedores (rata o ratón), esta técnica demostró ser mucho más sensible, aunque con una disminución en la especificidad diagnóstica que las células LE.
El uso de sustrato de hígado y riñón de roedores fue reemplazado por la línea celular Hep-2, el cual es el sustrato de elección en la actualidad, este sustrato es de mayor sensibilidad porque presentan mayor concentración de antígenos (100 a 150 antígenos), por ej: SSA/Ro, además permiten la detección de anticuerpos contra múltiples estructuras nucleares, citoplasmáticas y relacionadas con la división celular. Al presentar los núcleos un gran tamaño los patrones de fluorescencia son más fácilmente visualizables. La cantidad de patrones observados con células Hep-2 se ha incrementado con los años hasta llegar, aproximadamente a 50, teniendo en cuenta no sólo el teñido nuclear sino también el citoplasmático y de diferentes organelas como ser mitocondrias, Golgi, nucléolo y distintas estructuras del aparato mitótico tales como huso mitótico, centriolos, etc. Esto requiere de profesionales muy entrenados en la interpretación de imágenes. La IFI sigue siendo de elección ya que con técnicas como el ELISA tienen muchos falsos negativos por la menor cantidad de antígenos. Los patrones permiten la orientación en la especificidad antigénica del anticuerpo, para luego utilizar un método específico de identificación como ELISA, Western Blot, Inmunoensayo Lineal, Dot Blot, entre otros.
¿Cuáles son los problemas relacionados con la técnica de IFI?
En la determinación de ANA por IFI se presentan diversos problemas:
- Falta de unanimidad en el criterio para el título de corte.
- Título del informe
- Falta de consenso en el contenido del informe, cuáles son los datos más relevantes y cuáles no deben faltar. Los distintos informes pueden conducir a errores en la interpretación médica.
- Denominación de los patrones: se utilizan distintos nombres para identificar los mismos patrones; este hecho se debe a que el nombre de los patrones surge, en general, de la traducción del inglés al español.
- Dificultad en la estandarización de la técnica de IFI.
¿Cuáles son las variables que intervienen en la calidad analítica de los ANA por IFI?
Muchas son las variables que pueden intervenir en la calidad analítica del resultado:
-
Microscopio.
-
Recolección y almacenamiento de las muestras.
-
Elección del sustrato.
-
Conjugado fluorescente.
-
Especificidad isotípica del conjugado: en la determinación de ANA por IFI pueden ser usados tanto conjugados polivalentes (reactivos contra IgG, IgA e IgM) como conjugados anti-IgG específicos. El 96% de los pacientes con LES producen ANA de clase IgG. La mayoría de los autoanticuerpos asociados a daño, severidad o subtipos clínicos en las enfermedades autoinmunes sistémicas son de clase IgG. Si se utiliza un conjugado IgG específico no podrán ser detectados los ANA de clase IgM asociados con artritis reumatoidea, drogas o la edad. Sin embargo, sólo 4% de los pacientes con enfermedades autoinmunes sistémicas producen cantidades significativas de ANA IgM específicas
-
Sueros de referencia
-
Valor de corte
Para individuos adultos se propone hacer el screening a la dilución de 1:80 con una sensibilidad del 90 al 95% . En individuos más jóvenes se recomendaría una dilución de corte de 1:40. Se debe fijar el valor de corte de la determinación, o sea el título a partir del cual el resultado es considerado positivo. La importancia reside fundamentalmente en poder definir un positivo con verdadero significado clínico con muy buena especificidad y una adecuada sensibilidad.
¿Cómo se debe informar correctamente los ANA?
Se propone que en el informe se consigne la siguiente información: nombre de la determinación, método sustrato, dilución de corte, resultados, identificando la fluorescencia nuclear, aclarando título/s y patrón/es, y la fluorescencia citoplasmática, aclarando título/s y patrón/ es, dejando un lugar para observaciones. Las imágenes que se deberían informar son las que aparecen en verde.
Bibliografía
Primer Consenso Argentino para la Estandarización de la Determinación de Anticuerpos Anti-Nucleares por Inmunofluorescencia Indirecta–HEp-2 First Argentine Consensus for Standardization of Antinuclear Antibodies by Indirect Immunofluorescence–HEp-2 Primeiro Consenso Argentino para a Padronização da Determinação de Anticorpos Antinucleares por Imunofluorescência Indireta–HEp-2 Orlando Gabriel Carballo1ae, Fernanda Beatriz Ingénito2a, Alejandra
Autor: Dra. Patricia Gentili. Bioquímica Especialista en Inmunología Clínica
Fuente: Fares Taie Instituto de Análisis