EL LABORATORIO EN OSTEOPOROSIS
DETERMINACIONES BASICAS EN OSTEOPOROSIS
1-Hemograma
2-Eritrosedimentación
3-Creatinina sérica y urinaria
4-Glucemia
5-Proteinograma electroforético
6-Enzimas hepáticas.
7-Calcemia
8-Fosfatemia y fosfaturia
9-FAL
10-TSH
11-Orina completa
12-Ionograma
13-Magnesio sérico y urinario
DEFINICION DE MARCADORES BIOQUIMICOS:
Los marcadores bioquímicos del remodelado óseo se miden en plasma u orina y son proteínas o productos derivados de ellas. Son enzimas derivadas de osteoblastos u osteoclastos o son constituyentes de la matriz ósea, que se escapan a la circulación durante el proceso de formación o que son liberados como productos de ruptura durante la resorción. (1)(2)
(1) Horm. Metab. Res. 29 (1997) 138-144
(2) Delmas Osteoporosis (1996)
Los marcadores bioquímicos del turn over óseo proveen
información acerca de la tasa total de turn over del esqueleto.
Principalmente refllejan la frecuencia de activación de las unidades
de remodelado.
Debido a que las anormalidades del turn over óeso en osteoporosis
son de pequeña magnitud los marcadores convencionales son usualmente
normales.
Un exceso relativo de resorción ósea frente a formación ósea lleva a un deterioro de la microarquitectura del hueso. Esto no puede evaluarse a través de la densidad mineral ósea (DMO) y sí a través de los marcadores bioquímicos.
PROPIEDADES DESEABLES DE LOS MARCADORES BIOQUIMICOS DE METABOLISMO TISULAR:
1. Los marcadores deben ser tejido específico.
2. El metabolismo debe ser simple y preferentemente no influenciado por la función de otros órganos.
3. Los factores que controlan la síntesis y degradación del marcador deben estar bien definidos.
4. El ensayo para su medición debe ser sensible, específico y simple.
UTILIDAD CLINICA DE LOS MARCADORES BIOQUIMICOS
• Los marcadores bioquímicos no se deben emplear
para diagnóstico de osteoporosis.
• Su utilidad clínica es:
1- Evaluar el ritmo de pérdida de masa ósea.
2- Evaluar el riesgo de fractura
3- Monitoreo de la terapia.
1 -Contribuyen a conocer la velocidad del recambio óseo.
Identificación de “perdedoras rápidas” y “perdedoras lentas” de masa ósea.
En pacientes con valores borderline de masa ósea, aquellos con altos niveles de marcadores deberían tratarse y se deben observar los pacientes con marcadores bioquímicos normales. En este aspecto los marcadores ayudan en la decisión médica de tratar o no al paciente.
Ante un paciente con alto recambio óseo, debería investigarse la causa osteoporosis primaria o secundaria.
Enfermedades asociadas con osteoporosis (Osteoporosis secundaria)
Ginecológicas: amenorrea primaria, amenorrea secundaria prolongada o recurrente, oligomenorrea, anorexia nerviosa, hiperprolactinemia.
Endocrinológicas: hiperparatiroidismo, hipertiroidismo, hipercortisolismo, hipogonadismo masculino, acromegalia, diabetes tipo I.
Reumatológicas: artritis reumatoidea, lupus.Hematológicas: mieloma, linfoma, leucemias, mastocitosis, anemias drepanocíticas, talasemias.
Metabólicas: osteomalacia, porfiria, alcoholismo, enfermedad de Paget.
Neurológicas: parálisis o paresias.
Colagenopatías: sindrome de Ehlers-Danlos, osteogénesis imperfecta, sindrome de Marfan.
Digestivas: gastrectomía, síndrome de malabsorción, hepatopatías crónicas.
Renales: insuficiencia renal crónica, hipercalciuria, acidosis tubular renal.
Iatrogénica: tratamiento con corticoides, homonas tiroideas a dosis supresivas, anticoagulantes como la heparina, metrotexato, litio, análogos de LH-RH, administración crónica de anticonvulsivantes.
Hipercalcemia maligna, metástasis ósea.
2- Evaluar el riesgo de fractura.
La patogénesis de la fractura por fragilidad es multifactorial
involucrando no sólo el nivel de masa ósea sino también
la arquitectura ósea, el recambio y factores relacionados a caídas.
Un incremento en los marcadores de resorción predice riesgo de
fractura de cadera independiente de la densidad mineral ósea. (Garnero
et al J.Bone Miner Research 1996; 11: 1531-8. Van Daele et al. Br.Med.J.
1996; 312: 482-3).
La relación entre marcadores bioquímicos y densidad mineral ósea, no solamente es independiente sino que también es aditiva para evaluar el riesgo de fractura.
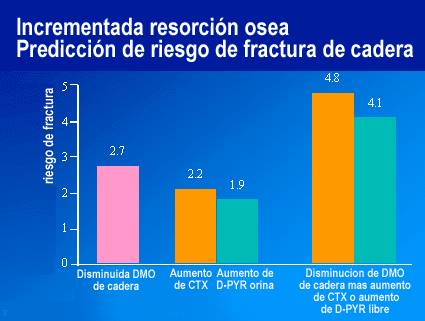
Un recambio óseo elevado es un predictor de riesgo de fractura aumentado, independientemente del nivel de DMO. Una DMO disminuida y un recambio óseo aumentado tienen aproximadamente igual poder para predecir riesgo de fractura.
Reduciendo el turnover óseo se previenen fracturas osteoporóticas. (Akesson et al. J. Bone Miner. Res. 1995; 10:1823-9).
3- Monitoreo de la terapia:
El dosaje de los marcadores bioquímicos provee información
sobre:
• adherencia al tratamiento
• absorción del fármaco.
• efecto esquelético del fármaco.
Posibilitan el monitoreo de la terapia a intervalos cortos ,
lo que no es factible con la densitometría.
Se observa si la respuesta al tratamiento antiresortivo (bifosfonatos,
estrógenos) fue exitosa dosando los marcadores a los
3-6 meses de iniciado el tratamiento, a diferencia de la densitometría
que no ofrece cambios tan dinámicos.
Si con el dosaje a los 6 meses postratamiento se concluye que el tratamiento fue exitoso, se aconseja el dosaje de los marcadores anualmente para determinar que la eficacia continúa y para lograr mayor adherencia al tratamiento.
Garnero y colaboradores notaron que una disminución en el recambio óseo luego de un tratamiento de 6 meses con bifosfonatos se asocia con un aumento de la BMD de la espina lumbar a los 2 años.
Se debe tener en cuenta que en un ciclo de remodelación, la resorción toma de 7 a 10 días y la formación requiere de 2 a 3 meses. Por lo tanto los marcadores de resorción responden más rápidamente a cambios en el remodelado que los marcadores de formación.
Las diferencias intraindividuales en los marcadores óseos presentes en suero (FAO,OSTEOCALCINA, PICP, CTX) son generalmente menores que en marcadores urinarios (NTX, DPYR, PYR Y CTX).Se considera un cambio significativo (para obviar los cambios intraindividuales y analíticos) un cambio del 15% para la osteocalcina y la FAO y un cambio de un 25-40 % para la piridinolina, deoxipiridinolina o NTX.
MARCADORES DE FORMACION OSEA
Suero:
FOSFATASA ALCALINA
- ACTIVIDAD TOTAL (FAL)
- ISOENZIMA OSEA (FAO)
OSTEOCALCINA
PEPTIDOS DE EXTENSION DEL PROCOLAGENO TIPO I: PINP, PICP
MARCADORES DE RESORCION OSEA
Suero:
FOSFATASA ACIDA TARTRATO RESISTENTE (sTRAP)
PIRIDINOLINA Y DEOXIPIRIDINOLINA=CROSSLINKS (s PYR- DPYR)
N-TELOPEPTIDOS (sNTX)
C-TELOPEPTIDOS (sCTX) (sCROSS LAPS)
Orina:
PIRIDINOLINAS Y DEOXIPIRIDINOLINAS (uPYR-DPYR)
N-TELOPEPTIDOS (u-NTX)
C-TELOPEPTIDOS (u-CTX)
INDICE CALCIO/CREATININA MATINAL (uCa/Cr)
HIDROXIPROLINA
GLICOSIDOS DE HIDROXILISINA
Garnero, Delmas. Endocrinology and Metabolism Clinics. Vol 27 N 2, June , 1998.
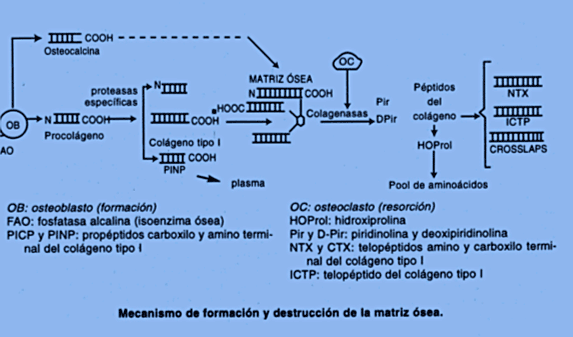
PINP: propetido del colageno tipo I.
Zeni, Wittich, Di Gregorio, Oviedo, Somoza, Gómez Acotto, Bagur, González, Portela, Mautalén. Utilidad clínica de los marcadores de formación y resorción ósea. Acta Bioquímica clínica latinoamericana. Vol XXXV, N1, 3-36, 2001.
MARCADORES DE FORMACION
FOSFATASA ALCALINA TOTAL (FAL)
• Introducción:
La FAL es una glicoproteína que se encuentra unida a las membranas celulares. Tiene una vida media en suero de 1-2 días por lo tanto su variación diurna es mínima.
En circulación hay 4 isoenzimas de la FAL: en el adulto hepática (60%), ósea (40%) (FAO) , placentaria e intestinal.
La isoenzima ósea es predominante en niños y sobre todo en la pubertad.
• Muestra : suero.
Método:
Hidrólisis enzimática del para nitrofenilfosfato. Espectrofotometría
cinética 405 nm. Recomendado por IFCC (30/3°C), DGKC (25°C/37°C).
Método de Bessey Lowry optimizado - Sustrato: paranitrofenilfosfato
de sodio (PNPF).
• Valor de referencia:
IFCC, en UI/l a 30°C
Adultos hombres < 60 años 30-90 U/L
Adultos mujeres < 60 años 30-80 U/L
| Niños (IFCC, en UI/L a 37°C) | ||
| 1-30 días | H: 75-316 | M: 48-406 |
| 1 Mes-1 año | H: 82-383 | M: 124-341 |
| 1-3 años | H: 104-345 | M: 108-317 |
| 4-6 años | H: 93-309 | M: 96-297 |
| 7-9 años | H: 86-315 | M: 69-325 |
| 10-12 años | H: 42-362 | M: 51-332 |
| 13-15 años | H: 75-390 | M: 50-162 |
| 16-18 años | H: 52-171 | M: 47-119 |
DGKC, en UI/l a 25°C
Adultos H 70-175 U/L
M 55-170 U/L
Niños
Hasta 10 días 110-450
11-30días 110-580
1-6 meses 140-720
7-12 meses 120-700
13-18meses 110-650
19-24 meses 110-590
2-9 años 110-500
10-15 años 130-700
• Utilidad de la FAL total:
Tiene dos aplicaciones clínicas muy útiles: en enfermedad obstructiva hepática y en enfermedad metabólica ósea, asociada a incremento de la actividad osteoblástica, es considerada un marcador bioquímico de recambio óseo.
La medición de FAL total es útil cuando la cantidad de FAO es excepcionalmente alta (como en la enfermedad de Paget) y la concentración de FAL no ósea no está aumentada y se encuentra estable.
La FAL total no es útil para el seguimiento de la osteoporosis donde los cambios ocurren dentro del rango de normalidad por ser un ensayo de escasa sensibilidad y especificidad. En el caso de la osteoporosis se aconseja la utilización de FAO y no de FAL total.
FOSFATASA ALCALINA OSEA (FAO)
• Introducción
Es sintetizada por los osteoblastos maduros y sus precursores. La FAO es una enzima localizada en la membrana de los osteoblastos que es liberada a la circulación.
La variabilidad biológica y diurna de la FAO es la mitad de la de deoxipiridinolina debido a que la FAO tiene una vida media mayor (1 – 2 días) en suero.
• Muestra: suero
• Valores de referencia:
Mujeres postmenopáusicas: 14.2-42.7 U/l
Mujeres premenopausia:11.6-29.6 U/l
Hombres:15-41.3 U/l
• Método:
Inmunoensayo:
ELISA o IRMA: con anticuerpos monoclonales. Presenta una reacción
cruzada de un 3-8% (dependiendo de la marca) con la isoenzima hepática
y de un 0.4% con la intestinal. Por ello valores aumentados de
la isoenzima hepática, pueden afectar a los valores de
la FAO. Esto se debe también a que la isoenzima hepática
es la predominante en adultos y la ósea en niños.
Además como la FAO es aclarada por el hígado,
puede encontrarse elevada en enfermedades hepáticas
Espectrofotometría:
También se puede medir por espectrofotometría evaluando
la actividad de fosfatasa alcalina antes y después de una precipitación
de la isoenzima ósea con lectina de germen de trigo. Empleando
una técnica prolija, la reactividad cruzada con la isoenzima hepática
es del 5 %, aunque tiene menor sensibilidad que el inmunoensayo.
La FAO es destruida por el calor a diferencia de las
otras isoenzimas, pero esta técnica no es reproducible.
La actividad de esta enzima aumenta con la edad en adultos, especialmente en mujeres después de la menopausia.
• Se encuentran valores aumentados:
Por deficiencia de estrógenos.
En el embarazo (en el segundo y tercer trimestre).
En pacientes con insuficiencia renal en hemodiálisis.
• Utilidad:
La medición de su actividad en suero es una medida indirecta del
proceso de formación.
Evaluar la velocidad de remodelado óseo ( es un marcador sensible de velocidad de remodelación ósea).
Monitoreo del tratamiento con antiresortivos (hormonas, bifosfonatos) en osteoporosis de mujeres postmenopáusicas. Por ejemplo durante el tratamiento con 10 mg/día de alendronato, disminuye la FAO a más del 25% a los 6 meses de tratamiento y la BMD de espina lumbar aumenta recién a los 2 años postratamiento.
• Cuenta con todos los beneficios de las determinaciones séricas:
pequeña variabilidad entre sujetos y baja variabilidad metodológica
y biológica.
PEPTIDOS DE EXTENSION DEL PROCOLAGENO TIPO I: PINP Y PICP
• Introducción:
El colágeno tipo I se sintetiza como un precursor, procolágeno
y contiene extensiones N y C terminal. Estas extensiones o propéptidos
son clivados del colágeno tipo I durante la formación de
la fibra y van a circulación.
Durante el procesamiento extracelular del colágeno tipo I hay un
clivaje de péptidos de extensión aminoterminal y carboxiterminal
antes de que el colágeno se incorpore a la matriz ósea.
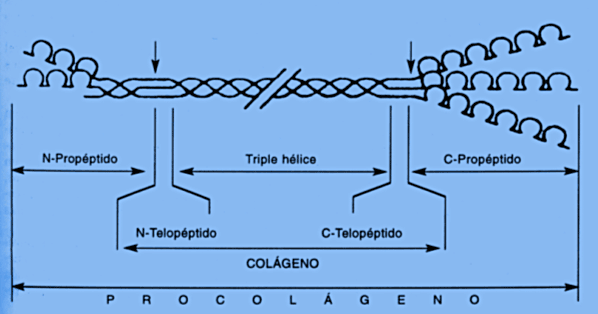
Este clivaje da lugar a 2 péptidos de extensión relativamente
largos llamados:
PICP: propéptido carboxiteminal del procolágeno
tipo 1 y
PINP: propéptido aminoterminal del procolágeno tipo 1.
Aproximadamente el 90 % de la matriz ósea sintetizada por los
osteoblastos está compuesto por colágeno tipo I, que es
secretada como procolágeno con un gran dominio N terminal y C terminal.
Extracelularmente, el clivaje proteolítico de los dominios C y
N terminal ocurre como un requisito para la síntesis correcta de
las fibras de colágeno.
La concentración en suero de estos propéptidos puede
ser usado como un marcador de la síntesis de colágeno tipo
I.
El PINP tiene una región helicoidal. Además no es excretada por los riñones sino que es aclarado por el hígado, por eso el dosaje es en suero.
La concentración sérica de PINP puede variar hasta 100 veces dependiendo del ensayo utilizado, sugiriendo heterogeneidad en las formas circulantes de PINP. Se desarrollaron inmunoensayos utilizando antígenos nativos y sintéticos. Los inmunoensayos basados en antígenos sintéticos dan resultados 100 veces mayores que los inmunoensayos basados en antígenos nativos.
El PINP muestra cambios más dinámicos que el PICP en respuesta a agentes que alteran el recambio óseo. El PINP detecta cambios en la enfermedad de Paget mientras que el PICP no. El PINP decrece su concentración mayormente que el PICP durante la terapia hormonal de reemplazo (42% versus 20% luego de 12 meses de tratamiento). Lo mismo ocurre en la metástasis ósea de carcinoma de mama.
Los PINP correlacionan con los valores de osteocalcina y FAO, sin embargo es menos sensible que estos últimos.
• Muestra: suero.
• Método: RIA
• Valor de referencia PINP:
19-84 ug/l en mujeres
20-76 ug/l en hombres
• Valor de referencia PICP:
50-170 ug/l en mujeres
38-202 ug/l en hombres
• Limitaciones: Refleja la síntesis de
colágeno tipo I óseo y de otros tejidos (por lo tanto tiene
una cierta inespecificidad), sin embargo el más abundante es el
óseo.
El antígeno detectado puede provenir también de la
degradación del colágeno (y lo que se quiere estudiar
con este marcador es la formación).
Utilidad clínica:
En menopausia se incrementan en un 20 % que no se correlaciona con la medición de la pérdida de hueso a través de la densitometría.
Monitoreo del efecto inhibidor de crecimiento durante la terapia con esteroides.
Evaluar en estudio de osteoporosis, metástasis ósea y enfermedad de Paget.
Evaluar: es útil para estudiar la formación ósea en pacientes tratados con 1,25 dihidroxi vitamina D o en pacientes con niveles anormales de vitamina D.
OSTEOCALCINA
Es la proteína no colágena más abundante de la matriz extracelular ósea. Está localizada en tejido óseo y dentina. Constituye un 25% de las proteínas de naturaleza no colágena.
Se la denomina proteína GLA o BGP, proteína no colágena
especifica de tejido óseo. Es sintetizada predominantemente por
los osteoblastos (odontoblastos también) e incorporada en la matriz
extracelular del hueso.
La producción de osteocalcina depende de tres vitaminas: VIT D,VIT
K, y VIT C. La síntesis involucra vitamina K para la formación
de ácido glutámico carboxilado y la 1,25 dihidroxi vitamina
D3 para la estimulación de la producción.
Es una proteína de 49 aminoácidos. Contiene 3 aminoácidos
carboxiglutámicos (GLA) que se utilizan para permitir a la osteocalcina
su unión a hidroxiapatita y calcio libre.
Las formas principales en circulación son la molécula intacta y el largo fragmento medio N-terminal de 43 aminoácidos (N-Mid osteocalcin o N-Mid fragment).
La osteocalcina se incorpora rápidamente a la matriz ósea. La porción que no se incorpora, difunde al suero, donde puede evaluarse como un marcador de formación ósea.
La presencia de osteocalcina con carboxilación disminuida se asocia con aumento del riesgo de fractura de cadera en la vejez, y se puede revertir con suplementación con vitamina K. La osteocalcina no carboxilada parece ser un mejor predictor de riesgo de fractura.
Tras la síntesis la osteocalcina es metabolizada luego de la
liberación obteniéndose las siguientes proporciones: 1/3
como molécula intacta (49 aa), 1/3 como fragmento largo medio N
terminal (43 aa), y 1/3 como fragmento medio-terminal y fragmentos pequeños.
Ver figura.
En cambio el metabolismo de la osteocalcina luego de su liberación
de la matriz ósea durante la resorción no se comprende completamente.
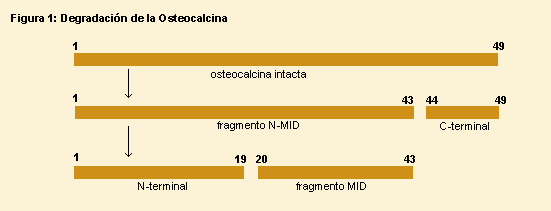
El fragmento largo N terminal medio (N-mid fragment) no se libera durante la degradación de la matriz ósea.
La secreción de osteocalcina sigue un ritmo circadiano
con un pico a las 4 AM y un nadir a las 5 PM. Esto habla de un recambio
óseo nocturno. Por este ritmo es importante estandarizar el momento
de la toma de muestra. La misma debe tomarse entre las
8-9 hs.
La molécula intacta representa el 35% del total de osteocalcina
en circulación en pacientes normales, un 45% en pacientes con osteoporosis
y un 25% en pacientes con insuficiencia renal crónica (IRC). El
N- mid fragment representa el 30% en sujetos normales y osteoporóticos
y el 50% en pacientes con IRC. Este fragmento no se libera ante la degradación
de matriz ósea, ya que se vio que sus niveles circulantes no cambian
luego de un tratamiento agudo con bifosfonatos. Esto es importante debido
a su utilidad como marcador de formación ósea.
Los valores son mayores en niños que en adultos, encontrándose
un pico en la pubertad (se correlaciona con el crecimiento del esqueleto).
En adultos los valores son relativamente estables, en cambio en la menopausia
aumentan, por aumentar el recambio óseo.
En general los valores son mayores en hombres que en mujeres premenopáusicas.
La osteocalcina circulante tiene una corta vida media (5 minutos) y es aclarada rápidamente por los riñones. Debido a esto, la concentración de osteocalcina en sangre refleja la síntesis de nueva proteína por lo tanto su medición provee una idea del metabolismo esquelético. Su concentración representa la actividad de los osteoblastos.
Durante la terapia antiresortiva disminuyen los marcadores de resorción ósea. Debido al acoplamiento también disminuyen los marcadores de formación como la osteocalcina, sin embargo esta disminución no es tan marcada como ocurre con los marcadores de resorción.
Muestra:
• Suero o plasma con EDTA o heparina. Es más estable en suero
porque la osteocalcina puede ser degradada in vitro por enzimas proteolíticas
liberadas por los eritrocitos. Por otro lado se debe tener en cuenta que
en los sueros lipémicos puede dar valores falsamente reducidos
por su unión a los lípidos.
Mantener en la heladera las primeras 4 horas post recolección.
Si transcurren más de 4 horas para su procesamiento, debe conservarse
a –20°C.
N-mid fragment (N-mid Osteocalcin)
Suero estable 8 horas entre 15-25°C
Plasma con heparina
3 días 2-8°C
3 meses –20°C
Plasma con EDTA
2 días a 15-25 °C
3 días a 2-8 °C
3 meses a –20°C
Luego de pocas horas a temperatura ambiente, una gran proporción de osteocalcina intacta se convierte en el fragmento largo medio N terminal resultando en una gran pérdida de inmunorreactividad con aquellos ensayos que reconocen la fracción C terminal de la molécula.
Método: IRMA (utiliza dos anticuerpos monoclonales,
uno reconoce la región 7-19 y el otro la región 37-49),
RIA, quimioluminiscencia.
En los diferentes inmunoensayos se encuentra variación dependiendo
del fragmento que dose y dependiendo de la especie utilizada (humana,
bovina) que tendrán diferentes epitopes.
Los inmunoensayos que presentan mayor información clínica
son los que dosan dos fracciones a la vez: la osteocalcina intacta y el
fragmento largo medio N terminal. Estos ensayos son más robustos
y más sensibles.
• Valores de referencia: (Intacta)
Hombres: 11.1-32.2 ng/ml
Mujeres: 3.8-30 ng/ml
(N-MID fragment+N-terminal)
Hombres: 11-46 ng/ml
Mujeres:
Premenopausia: 12-41 ng/ml
Postmenopausia: 20-48 ng/ml
Utilidad clínica:
Monitoreo de la terapia hormonal de reemplazo en pacientes post-menopaúsicas.
Monitoreo de la terapia en pacientes con osteoporosis tratadas.
Evaluación de pacientes osteoporóticas.
Marcador bioquímico específico de formación ósea, capaz de predecir el perfil histológico, en pacientes con osteoporosis post menopaúsica. Es una medida de la velocidad de formación de hueso trabecular. Es marcador de remodelación ósea cuando formación y resorción están acoplados. Es marcador de formación cuando formación y resorción están desacoplados.
Monitoreo del tratamiento en pacientes con enfermedad de Paget, acromegalia y el hiperparatiroidismo primario y secundario.
Evaluación de pacientes tratados con glucocorticoides
por períodos prolongados.
Los glucocorticoides suprimen la formación osteoblástica,
por lo tanto la osteocalcina (marcador de formación ósea)
disminuye durante el tratamiento con glucocorticoides Se correlaciona
con el crecimiento del esqueleto, en la pubertad. Los glucocorticoides
causan osteopenia a través de diversos mecanismos: inhibición
de función osteoblástica, aumento del número de osteoclastos
y disminución de la absorción intestinal de calcio que produce
aumento de PTH.
La osteocalcina disminuye a los 3 meses de tratamiento con 10 mg/día de alendronato.
• Valores aumentados:
Hiperparatiroidismo primario o secundario
Hipertiroidismo
Metástasis ósea.
Acromegalia
Enfermedad de Paget
IRC
Osteomalacia
Osteítis fibrosa
Osteodistrofia renal
Tratamiento con fluoruros, vitamina D y GH(hormona de crecimiento)
Los valores aumentan luego de la menopausia.
• Valores disminuidos:
Hipoparatiroidismo
Hipotiroidismo
Pacientes tratados con glucocorticoides.
Mieloma múltiple
Hipercalcemia maligna
Por administración de estrógenos, calcitonina, bifosfonatos
y glucocorticoides (los glucocorticoides suprimen la formación
osteoblástica , por lo tanto la osteocalcina que es un marcador
de formación ósea disminuye durante el tratamiento con glucocorticoides.
Los glucocorticoides causan osteopenia a través de diversos mecanismos:
inhibición de función osteoblástica, aumento del
número de osteoclastos, disminución de la absorción
intestinal de calcio que produce aumento de PTH)
MARCADORES DE RESORCION OSEA
EXCRECIÓN URINARIA DE CALCIO
• Muestra: Se utiliza la relación calcio/creatinina en orina de ayuno, para descartar el calcio proveniente de la dieta.
• Valor de referencia:
Los valores deben ser menores de 0.11 mg calcio/mg creatinina.
• Limitaciones: De escasa sensibilidad
Es afectado por la dieta (esto no ocurre en la orina de ayuno)
Es afectado por la función renal ( calcio proveniente de la reabsorción
renal)
Es afectado por el muestreo y por un exceso de PTH y estradiol.
• Utilidad: en enfermedad de Paget y en metástasis
ósea.
Valores en exceso indican pérdida mineral ósea.
Es útil para diferenciar perdedoras lentas de masa ósea
de perdedoras rápidas. Tiene un alto valor predictivo negativo
como indicador de alto recambio óseo.
No se encuentran bajos niveles de excreción urinaria de calcio
en pacientes con alto recambio óseo, excepto cuando el esqueleto
está pobremente mineralizado debido a déficit de calcidiol
y calcitriol o a aumento de PTH.
FOSFATASA ACIDA
• Introducción:
Es una enzima lisosomal.
Existen 5 isoenzimas en circulación: ósea, prostática,
plaquetaria,eritrocitaria y proveniente del bazo.
La isoenzima ósea se denomina TRAP: fosfatasa ácida tartrato
resistente y deriva del osteoclasto.
La isoenzima ósea juega un papel importante en el proceso de resorción.
• Desventajas:
Se han desarrollado inmunoensayos para la isoenzima ósea
pero no se logró especificidad.
La enzima de la muestra es inestable a pH no ácidos.
En los estados patológicos se observan cambios pequeños
en su concentración.
La isoenzima es liberada mayormente en el microambiente óseo y
no a circulación.
HIDROXIPROLINA URINARIA
• Introducción:
La hidroxiprolina es el aminoácido predominante del colágeno.
El 10% de los aminoácidos de la cadena alfa del colágeno tipo 1 es la hidroxiprolina, de la que, cuando el hueso se degrada, una parte pasa a circulación y se elimina por orina. Sin embargo, como la hidroxiprolina puede provenir del colágeno no óseo y además parte de este aminoácido se metaboliza y reutiliza para la síntesis de otras proteínas, no es el marcador ideal para la determinación de la degradación del tejido óseo.
Este marcador refleja la degradación del colágeno.
• Limitaciones:
Es un marcador de resorción ósea bastante inespecífico (se encuentra en gran proporción en la fracción C1q del complemento, en el colágeno no óseo, colágeno de la dieta y también proveniente de la ruptura de los péptidos de extensión procolágeno que son productos de formación ósea). El hecho de encontrarse en gran proporción en la fracción C1q del complemento lleva a que en condiciones inflamatorias se puedan hallar altos niveles de hidroxiprolina.
Otra desventaja es que el paciente debe seguir una dieta estricta 3 días previos a la recolección de orina.
Además es de escasa sensibilidad para el monitoreo de la osteoporosis ya que gran parte se cataboliza en el hígado (sólo el 10% de la hidroxiprolina se excreta por orina por lo tanto la hidroxiprolina urinaria representa sólo un 10% del total del catabolismo del colágeno).
Correlaciona pobremente con la histomorfometría ósea.
• Utilidad: es útil en la enfermedad de Paget.
• Valor de referencia: 12 –28 mg/ 24 horas o 15-45 mg/24 hs. (Prockoff Underfriend).
• Método: colorimétrico. Se hidroliza la muestra con HCl. Se oxida con cloramina T. Se realiza una extracción con tolueno y se ve desarrollo de color con reactivo de Erlich (para dimetil aminobenzaldehído en medio ácido).
• Muestra: orina de 24 horas.
GLICOSIDOS DE HIDROXILISINA
• Introducción:
Los glicósidos de hidroxilisina derivan del colágeno tipo
1. La hidroxilisina deriva de la hidroxilación postranscripcional.
La forma monoglicosilada (galactosilhidroxilisina) es la predominante
en hueso, y la forma diglicosilada (glucosil galactosil hidroxilisina)
es la predominante en piel.
• Método: HPLC
• Muestra: Suero.
• Utilidad: Es un marcador de resorción ósea.
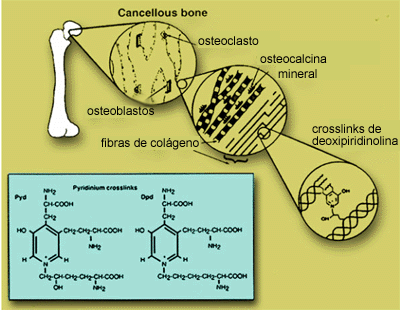
CROSSLINKS ( PIRIDINOLINA-PYR Y DEOXIPIRIDINOLINA-DPYR)
La piridinolina y la deoxipiridinolina son aminoácidos no reducibles
que unen entre sí las fibras de colágeno maduro. Se encuentran
en la matriz del hueso y del cartílago.
El colágeno tipo I, rico en aminoácidos hidroxiprolina,
tiene una estructura de triple hélice, con fibras conectadas por
cross links (entrecruzamientos) entre residuos de lisina e hidroxilisina
que unen extremos carboxi y amino terminales no helicoidales de una molécula
de colágeno; con una porción helicoidal de una molécula
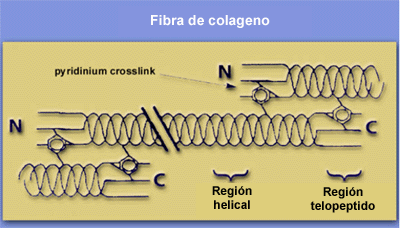
adyacente. Ver gráfico fibra de colágeno.
Las fibrillas inmaduras de colágeno no tienen la fuerza de tensión
necesaria hasta que no son unidas por una serie de uniones covalentes
intra e intermoleculares o cross links.
Dos cross links no reducibles maduros han sido identificados: deoxipiridinolina
(lisil piridinolina) formada por la reacción de dos hidroxilisinas
y una lisina y la piridinolina (hidroxilisilpiridinolina) formada por
la reacción de tres hidroxilisinas. Ver gráfico.
La PYR y DPYR se forman durante la maduración de las fibras de colágeno y no se encuentran presentes en el procolágeno, por lo tanto su liberación del hueso solo representa degradación de colágeno óseo maduro.
La proporción relativa entre PYR y DPYR es variable de acuerdo
con las especies. La PYR/DPYR se encuentran en una relación 3:1
pero la DPYR es más específica de tejido óseo que
la PYR. La DPYR se encuentra en cantidades significativas en hueso, ligamentos
y aorta mientras la PYR se halla más ampliamente
distribuida (tejido conectivo con mayores niveles en cartílago).
Los cross links no son exclusivos del hueso, pero como el tejido óseo
es el mayor reservorio del colágeno tipo1 del cuerpo y se remodela
más rápidamente que el resto de los tejidos conectivos,
se considera que la mayoría de los cross links presentes en la
orina de una adulto serán los que provengan de la resorción
ósea.
Mediante el proceso de resorción, el colágeno comienza a degradarse liberando formas libres de cross links (40%) y unidas a péptidos (60%) excretándose por orina.
La DPYR parece ser un marcador de resorción ósea más
específico y sensible debido a:
- Se forma durante la maduración del colágeno (no durante
la biosíntesis)
- Se origina sólo como producto de degradación de la matriz
ósea
- El hueso es su mayor origen
- No está influenciada por la dieta.
La ventaja de esta determinación con respecto al dosaje de hidroxiprolina radica en su mayor especificidad, en la independencia de la dieta previa en la recolección de orina, y su mayor sensibilidad, ya que no se ha comprobado que se metabolice antes de excretarse (a diferencia de la hidroxiprolina que se metaboliza marcadamente antes de excretarse por los riñones).
La excreción de PYR y DPYR tiene ritmo circadiano con valores
mayores durante la noche y un nadir durante la tarde, similar al ritmo
de la osteocalcina. Probablemente esto refleje un incremento nocturno
de la remoción, debido a que la excreción de cross links
diminuye un 30% entre las 8 y las 13 horas, por lo que el tiempo de recolección
de la muestra es importante para obtener resultados reproducibles.
Los valores en niños son mayores que en adultos. Los valores en
adultos son estables y aumentan un 50-100% en la mujer menopáusica
(debido a la disminución de estradiol, el cual es un inhibidor
de la resorción ósea) y se reduce a valores premenopáusicos
en mujeres bajo terapia hormonal de reemplazo (THR).
Luego de una degradación hepática y renal de los NTX y CTX, se liberan PYR y DPYR.
• Muestra: orina de 24 horas, orina de 12 horas o segunda orina de la mañana.
• Método: el método de referencia es HPLC pero es poco práctico. ELISA, RIA.
• Valores de referencia:
DEOXIPIRIDINOLINA O LIBRE (RIA)
Mujer: 3 –7 mM DPYR /mM creatinina
Hombre: 2.3-5.4 mM DPYR/mM creatinina
PIRIDINOLINA
Mujer: 4-19 nM/mM de creatinina
Hombre: 4-21 nM/mM de creatinina
• Ventajas de la determinación de DPYR frente a la de hidroxiprolina:
No son metabolizados antes de excretarse, a diferencia de la hidroxiprolina. Por ello es un parámetro mucho más sensible de la resorción ósea.
Es específico de recambio óseo. En cambio la hidroxiprolina se encuentra en lugares extraóseos.
La DPYR y PYR no se absorben o metabolizan de la dieta por lo tanto no es necesaria una dieta previa a su dosaje.
• Utilidad :
Monitoreo de la terapia hormonal de reemplazo en mujeres post*-menopaúsicas, siendo su principal utilidad en el monitoreo del control con estrógenos.
La DPYR disminuye durante el tratamiento con antiresortivos. La DPYR disminuye durante el tratamiento con antiresortivos, por lo tanto es útil en el monitoreo de la terapia ( la DPYR disminuye a los 3 meses de tratamiento con 10 mg/día de alendronato).
Como el proceso de resorción ósea es más corto que el proceso de formación, los marcadores de resorción responden más rápidamente a cambios en la remodelación que los marcadores de formación.
Evaluar la velocidad de recambio óseo.
Evaluar el riesgo de fractura.
La DPYR aumenta en patologías que aumentan la resorción ósea.
NTX: N TELOPEPTIDOS (INTP)
• Introducción:
Los telopéptidos son fragmentos que están unidos a crosslinks
específicos del colágeno tipo I, existen dos tipos de regiones
en el colágeno tipo I, el cual forma el 90% de la matriz orgánica
del hueso: N-telopéptidos y C-telopéptidos (ICTP). Los N-telopéptidos
o NTX o INTP se encuentran enriquecidos con deoxipiridinolina comparados
con los ICTP.
Una porción del ciclo PYR unida a la hebra de colágeno forma
el N-telopéptido NTX urinario que proviene solamente del hueso.
Los telopéptidos están unidos a una porción helicoidal de una molécula vecina a través de los crosslinks.
Estos fragmentos representan un espectro de proteínas de diferente
tamaño.
Los pequeños fragmentos de degradación del telopéptido
del colágeno tipo I son liberados al fluido extracelular cuando
el colágeno tipo I es degradado por los osteoclastos durante la
resorción ósea. Estos fragmentos parecen ser específicos
de hueso ya que poseen el tipo de entrecruzamiento del colágeno
maduro tipo I de este origen, que no ocurre en el colágeno tipo
I de otras fuentes.
El N telopéptido muestra un ritmo circadiano con un pico de excreción
durante la mañana temprano (5-8 a.m.) y un nadir a la tarde (2-11
pm), con una abrupta declinación entre la mañana temprana
y el mediodía.
El NTX tiene un bajo coeficiente de variación intraindividual comparado
con la hidroxiprolina y la deoxipiridinolina total.
Una ventaja de la medición de NTX es que no dan reacción
cruzada con péptidos del colágeno tipo II, por ej: artritis
reumatoidea, osteoartritis y enfermedad de Paget. Esto mejora mucho la
especificidad de estos ensayos.
Cuando se comparan los valores pre y postmenopausia los telopéptidos
están usualmente más aumentados que otros marcadores de
resorción y formación ósea.
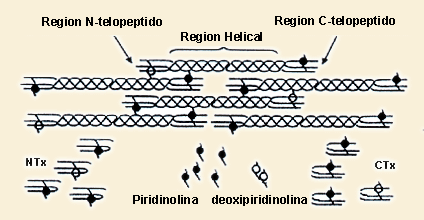
• Muestra: Orina de 24 horas.
• Valor de referencia:
Mujer premenopausica: 5-65 nM (bone collagen equivalents)/mM de creatinina
Hombre: hasta 85 nM (BME)/mM de creatinina
Utilidad clínica:
Monitoreo de la terapia hormonal de reemplazo en mujeres postmenopáusicas. Los niveles de NTX aumentan en la menopausia y generalmente en la osteoporosis pero declinan significativamente después del tratamiento con estrógenos y bifosfonatos. Se considera cambio significativo cuando el mismo es del orden del 25-40%.
Monitoreo de la terapia antirresortiva en individuos diagnosticados con osteoporosis.
Monitoreo de la terapia antirresortiva en individuos diagnosticados con enfermedad de Paget.
CTX o ICTP : telopéptido carboxiterminal del colágeno tipo I
Sinonimia: ICTP, ßCROSS LAPS, CTX
Método: RIA, ELISA, quimioluminiscencia
Muestra:
Orina 24 hs, segunda orina de la mañana, evitar la exposición
a la luz y al sol.
Para monitoreo es necesario recolectar la muestra siempre en los mismos
tiempos para que los datos sean comparables.
Plasma: ßCROSS LAPS.
Valor de referencia:
Orina: 126 +/- 38 µg /mmol creatinina
Plasma: ßCROSS LAPS| Hombres: | Valor Medio | Rango |
| 30-50 años: | 300 pg/ml | 16-584 pg/ml |
| 51-70 años: | 304 pg/ml | 10-704 pg/ml |
| >70 años: | 394 pg/ml | 20-854 pg/ml |
| Mujeres: | Valor Medio | Rango |
| Premenopaúsicas | 299 pg/ml | 25-573 pg/ml |
| Postmenopaúsicas | 556 pg/ml | 104-1008 pg/ml |
Ventaja: Su dosaje no se ve afectado por la determinación de creatinina, variaciones diurnas en la excreción de creatinina urinaria, recolección de la muestra de orina.
Significado clínico:
El CTX consiste en una secuencia peptídica de 26 residuos de aminoácidos
incluidos dentro de la cadena ![]() 1
del C telopéptido. Generalmente los ensayos para su determinación
están dirigidos hacia una secuencia de 8 residuos de aminoácidos.
1
del C telopéptido. Generalmente los ensayos para su determinación
están dirigidos hacia una secuencia de 8 residuos de aminoácidos.
En el C-telopéptido, la secuencia Asp-Gli es un sitio potencial
para una isomerización ß. Esto alteraría la estructura
espacial del octapéptido y como dicha reacción ocurre espontáneamente
en el tiempo está generalmente aceptado que dicha isomerización
se asocia con la edad de las proteínas y de los péptidos.
Aumenta con la edad del hueso y alcanza un equilibrio a los tres años
de mineralización del mismo.
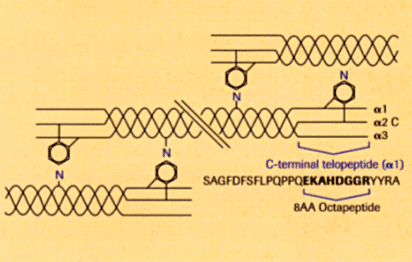
Esto hace que el CTX pueda encontrarse en dos formas isoméricas
distintas: ![]() o ß. Durante
la resorción ósea, ambas formas se liberan a circulación
y se eliminan por orina.
o ß. Durante
la resorción ósea, ambas formas se liberan a circulación
y se eliminan por orina.
Los pequeños fragmentos de degradación del telopéptido
de colágeno tipo I son liberados al fluido extracelular durante
la resorción ósea. Estos fragmentos parecen ser específicos
de hueso ya que poseen el tipo de entrecruzamiento del colágeno
maduro tipo I de este origen, que no ocurre en el colágeno tipo
I de otras fuentes.
Existen dos tipos de regiones en el colágeno tipo I: N-telopéptidos
y C-telopéptidos.
Los N- telopéptidos o NTX o INTP se encuentran enriquecidos
con DPYR comparados con los ICTP (C-telopéptidos).
Tienen una variación circadiana con un máximo entre las 4 y 9 AM y valores mínimos por la tarde.
• Utilidad clínica:
Evaluar la velocidad de recambio óseo.
Monitoreo de la terapia.
Da valores aumentados en enfermedad de Paget, hipertiroidismo, etc.
En la enfermedad de Paget que se caracteriza por un remodelamiento aumentado
en áreas localizadas del hueso, se encuentra aumentada la relación
alfaCTX / beta CTX.
En el hiperparatiroidismo primario que también se caracteriza por remodelamiento óseo aumentado, la relación alfaCTX / beta CTX permanece normal.
Este resultado sugiere que el colágeno recientemente sintetizado se caracteriza por una escasa isomerización, abriendo así nuevas perspectivas para el uso clínico de estos marcadores, ya que no sólo determinarían cambios cuantitativos del remodelamiento, sino también evaluarían la calidad del hueso formado. Se diferencia hueso recién formado del viejo por medio de sus isómeros.
Bibliografía:
1. Rafel Fonseca,1 , Michael C. Trendle, 1 , Traci Leong, 2 , Robert
A. Kyle, 1, Martin M. Oken, 3 , Neil E. Kay, 3 , Brian Van Ness 4 and
Philip R. Greipp 1 . Pronostic value of serum markers of bone metabolism
in untreated multiple myeloma patients. British Journal of haematology
109 (1), 24-29.
2. Aman s., Paimela L., Leirisalo-Repo M, Ristelli J. Kautiainen H., Helve
T., Hakala M. Predection of disease progression in early rheumatoid arthritis
by CRP. A comparative 3-year follow-up study. Rheumatology (Oxford) 2000
Sep:39 (9): 1009-13.
3. Paul D. Miller, MD, Daniel T. Baran, MD, John P. Bilezikian, MD, Susan
L. Greenspan, MD, Robert Lindsay, MBCHB, PHD, B. Lawrence Riggs, MD and
Nelson B. Watts, MD. Practical Clinical Application os Biochemical Markers
of Bone Turnover. Journal of Clinicla Densitometry; 1999, 2N°3: 323-342.
4. Robert H. Christenson. Biochemical Markers of Bone Metabolism: An Overview.
Clinical Biochemistry; 1997, 30 : 573-593.
5. Zeni S. ,Wittich A., Di Gregorio S. , Casco C., Oviedo A., Somoza J.,
Gómez Acotto C., Bagur A., González D., Portela M., Mautalén
C. Utilidad clínica de los marcadores de formación y resorción
ósea. Acta Bioquímica Clínica Latinoamericana. Vol
XXXV, N°1, 3-26;2001.
6. Lawrence G. Raiz. Physiology and Pathophysiology of Bone Remodeling.
Clinical Chemistry, Vol 45:8(B), 1353-1358; 1999.
7. Hoshimo H., Takahashi M., Kushida K., Ohishi T., and T. Inoue. The
Relationship Between the Degree of ß-Isomerization of Type I Collagen
Degradation Products in the Urine and Aging, Menopause and Osteoporosis
with Fractures. Osteoporosis Int. (1999) 9:405-409.
8. Garnero Patrick, Sornay-Rendu Elisabeth, Claustrat Bruno and Delmas
Pierre. Biochemical Markers of Bone Turnover, Endogenous Hormones and
Risk of Farctures in Postmenopausal Women: The Ofely Study. Journel of
Bone Mineral Research. (2000) 15:1526-1536.
9. Gallagher J. Christopher. Osteoporosis. Role of Estrogens in the Management
of Postmenopausal Bone Loss. Rheumatic Diseases Clinics of North America.
(2001) 27: 1-18.
10. Chapurlat R.D., Garnero P., Breart G., Meunier P.J. and Delmas P.
Serum Type I Collagen Breakdown Product (Serum CTX) Prdeicts Hip Fracture
Risk in Elderly Women: The EPIDOS Study. Bone 27 N 2 August 2000: 283-286.
11. Delmas P. Biochemical Markers of Bone Turnover I: Theoretical Considerations
and clinical Use in Osteoporosis. The American Journal of Medicine (1993)
95 Suppl 5ª: 11S-16S.
12. Bauer Douglas, Sklarin Peter M, Stone Katie L. et al. Biochemical
Markers of Bone Turnover and Prediction of Hip Bone Loss in Older Women:
The Study of Osteoporotic Fractures. Journal of Bone and Mineral Reserach.
(1999) 14: 1404-1410.