La fibrosis quística (FQ) es la enfermedad hereditaria letal más frecuente en las poblaciones caucásicas, de herencia autosómica recesiva, con una incidencia de alrededor de 1/4.500 recién nacidos vivos; se calcula que aproximadamente una de cada 25 personas es portadora heterocigota sana de alguna de las mutaciones de la enfermedad. Un 10% de los pacientes de FQ no tienen ninguna mutación conocida y existe una regular relación entre fenotipo y genotipo. La enfermedad está causada por mutaciones en un gen, que codifica una proteína que regula el paso de iones a través de las membranas, denominada cystic fibrosis transmembrane conductance regulator (CFTR). El test del sudor fue descrito por Gibson y Cooke en el año 1959 y continúa siendo en la actualidad el método de diagnóstico principal de la FQ.
La clínica o los denominados rasgos fenotípicos de la FQ incluyen cuatro grupos: enfermedad sinopulmonar crónica, alteraciones gastrointestinales y nutricionales, cuadros producidos por las pérdidas excesivas de sal por el sudor y ausencia bilateral de conductos deferentes en los varones.
Tradicionalmente, se ha considerado que la FQ era una enfermedad severa que producía síntomas graves desde los primeros meses de vida, pero en la actualidad se sabe que existe un amplio abanico de formas de presentación clínica, con afectación muy variable y de manifestación en cualquier edad, por lo que el diagnóstico de la enfermedad a través de los distintos métodos diagnósticos, fuera de la clínica, se convierte en más importante.
Según el último consenso de la European Cystic Fibrosis Society, diferencian dos tipos de diagnóstico:
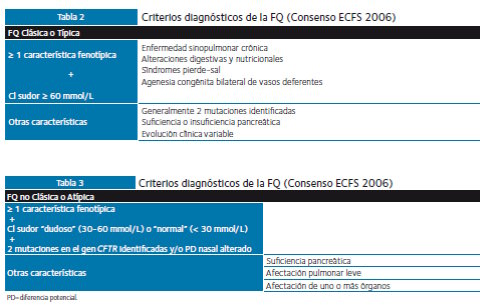
- FQ clásica: uno o más rasgos fenotípicos característicos junto a una concentración de cloro en sudor mayor o igual de 60 mmol/L.
- FQ no clásica o atípica: uno o más rasgos fenotípicos, más prueba del sudor con resultado dudoso (entre 30-60 mmol/L), más identificación de dos mutaciones causantes de la enfermedad y/o una diferencia de potencial transepitelial nasal anormal.
Las manifestaciones más frecuentes de la enfermedad son la insuficiencia pancreática exocrina en alrededor del 85-90% de los casos, la enfermedad pulmonar obstructiva crónica grave característica, que se desarrolla con el tiempo en casi todos los casos, la azoospermia obstructiva por anomalías anatómicas en el tracto urogenital en la casi totalidad de los varones, y altas concentraciones de cloro y sodio en el sudor en más del 98% de los casos.
Algunas de las conclusiones del Consenso fueron desde el principio objeto de controversia, por ejemplo, diagnosticar de FQ a un adulto, por otra parte sano, cuyo motivo de consulta es la infertilidad, o – vista la variable relación del genotipo con el fenotipo – los diagnósticos basados en los resultados del cribado neonatal en lactantes sin síntomas característicos de la enfermedad, o bien considerar evidencia clínica suficiente de la enfermedad la presencia de síntomas de vías aéreas superiores únicamente.
En el Consenso Europeo de 2006, que coloca de nuevo la clínica y el test del sudor en el centro del diagnóstico de la FQ; y propone unos algoritmos sobre la metodología diagnóstica a seguir, partiendo del resultado del test del sudor a ser utilizado en todos los casos,
Salvo en el del cribado neonatal, en el que se propone otro algoritmo, que parte del resultado del estudio genético. La propuesta del Consenso de 2006 de diagnosticar “fibrosis quística clásica” en presencia de al menos una manifestación fenotípica, junto con una concentración de cloro en el sudor ≥ 60 mmol/L, y “fibrosis quística no clásica o atípica” en presencia de un test del sudor “dudoso” (definido por una concentración de cloro en el sudor de 30-60 mmol/L), o incluso “normal” (cloro < 30 mmol/L), junto con la presencia de 2 mutaciones causantes de enfermedad y/o un diferencia de potencial nasal (DPN) alterado.
La Diferencia de Potencial Nasal (DPN) es una prueba diagnóstica complementaria en el estudio de la FQ. Es útil en pacientes con concentraciones de cloro dudosas, o en los que no se identifican las dos mutaciones del gen CFTR.
El epitelio nasal regula la composición de fluidos de la superficie de las vías respiratorias mediante el transporte activo de los iones sodio y cloro. Este transporte genera una diferencia de potencial transepitelial que es negativa respecto a la submucosa, y que se expresa en milivoltios (mV). Los pacientes con FQ, por el anormal comportamiento de la proteína CFTR, presentan una DPN más negativa que los individuos sanos.
Para la realización de la DPN se requieren dos electrodos conectados a un voltímetro, uno colocado sobre la mucosa del cornete inferior y otro en el tejido celular subcutáneo del antebrazo. Un valor inferior a –40 mV se considera patológico.
Se acepta la disfunción de la proteína CFTR con dos determinaciones anormales de DPN registradas en dos días diferentes. Pueden observarse falsos negativos cuando la integridad del epitelio está alterada.
El Consenso de 2006, declara que “para algunos pacientes con FQ no clásica y afectación de un solo órgano, puede ser más apropiado utilizar una etiqueta diagnóstica atenuativa según la propuesta de la clasificación de la OMS de trastornos relacionados con la FQ”.
Hace notar que existen tres situaciones en la práctica clínica en la que se puede plantear el diagnóstico de FQ.
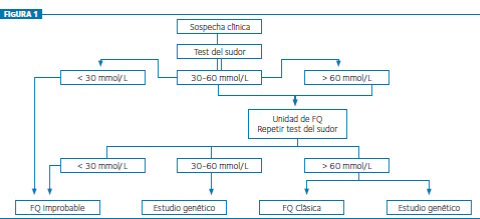
En primer lugar, la sospecha clínica por los síntomas del paciente, o bien la historia familiar de FQ en un hermano -en ambos casos, se debe utilizar el algoritmo de la Figura 1, que parte del resultado del test del sudor-.
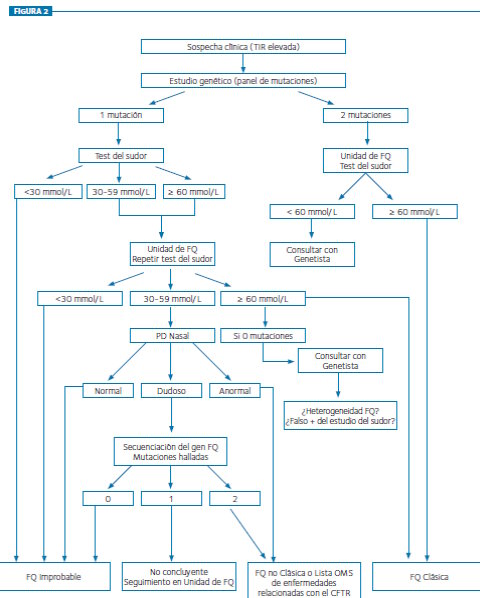
Finalmente, el diagnóstico se puede suscitar en el contexto del cribado neonatal (Tarjeta neonatal IRT), en cuyo caso se propone otro algoritmo (Figura 2), que partiendo de una elevación de los valores de tripsina inmunoreactiva, continúa con la realización de un estudio genético que, mediante el estudio de un panel de mutaciones, tenga capacidad para la detección de al menos el 80% de los alelos mutantes en la población a la que pertenece el paciente. Se recalca que ni el estudio genético ni el DPN tienen la sensibilidad ni la especificidad del test del sudor para el diagnóstico de la FQ, y recuerda que aunque se identifiquen dos mutaciones, el impacto clínico de muchas de las mutaciones raras es poco conocido, e incluso algunas pueden no ser auténticas mutaciones, y muy pocas unidades poseen la experiencia suficiente como para otorgar relevancia diagnóstica a las determinaciones del PD nasal de manera aislada.
El Consenso 2006 considera que las concentraciones de cloro en sudor de 30-59 mmol/L son dudosas y propone someter a todos estos pacientes a un protocolo que sigue con la realización de una prueba genética. Si este estudio no detecta ninguna mutación, recomienda considerar diagnósticos alternativos. Si se detectan ambas mutaciones, se puede realizar el diagnóstico de FQ no clásica o atípica, o alternativamente elegir una de las entidades relacionadas con la FQ en la lista de la clasificación OMS.
Si la prueba genética detecta una mutación, propone que se realice un rastreo completo de toda la región codificante del gen CFTR y sus regiones intrónicas limítrofes, así como la realización de un DPN. Con el hallazgo de la segunda mutación o un resultado anormal del DPN, se podría diagnosticar FQ atípica o entidad relacionada con la FQ (lista OMS), y un resultado negativo de ambos estudios haría replantearse el diagnóstico.
El Consenso de la CFF de 2008, señala que el límite de 30 mmol/L es apropiado para lactantes (especialmente en los de menos de 6 meses), pero en el resto de la población infantil es aconsejable elevar el límite normal de la concentración de cloro en el sudor hasta los 39 mmol/L, lo que concuerda con la opinión de los autores.
Otra aportación del Consenso 2006 es que divide las posibles manifestaciones clínicas de la enfermedad entre “altamente sugestivas” y “menos específicas”. La constatación en dos muestras de concentraciones de cloro en el sudor superiores a 60 mmol/L es consistente con FQ. Es raro en lactantes sin FQ encontrar concentraciones de cloro entre 40 y 59 mmol/L. A esta edad, 40 mmol/L representa 3 desviaciones estándar por encima de la media.
Las concentraciones de cloro en el sudor en la población no FQ aumentan ligeramente con la edad.
No obstante, el límite de 60 mmol/L, es por lo general adecuado, incluso en adultos.
De 1 a 2% de los pacientes con FQ pueden tener concentraciones de cloro en sudor repetidamente dudosas o normales. Se ha observado la alta prevalencia de tales determinaciones en pacientes con FQ portadores de la mutación 3849 + 10 kb C > T, que a nivel mundial representa el 0,2% de las mutaciones FQ.
La Cystic Fibrosis Foundation de Estados Unidos, establece, en su último consenso, que en los lactantes, se debe considerar resultado dudoso entre 30-59 mmol/l y en pacientes de más edad entre 40-59 mmol/l; valores indicio de FQ en cualquier edad > 60 mmol/l.
El test del sudor se basa en la medición de la concentración de cloro en el sudor, estimulado mediante iontoforesis con pilocarpina. El único método que se reconoce en la actualidad como válido para el diagnóstico de FQ es la medición bioquímica de la concentración de cloro y, si es posible, también de sodio en el sudor, después de la estimulación del sudor con pilocarpina. Es lo que se denomina «test cuantitativo de iontoforesis por pilocarpina». Se necesitan al menos dos tests cuantitativos de iontoforesis por pilocarpina positivos para el diagnóstico de FQ. Es conveniente realizarlo a partir del mes de vida para obtener resultados fiables.
Los resultados obtenidos por otros métodos de recogida o de análisis (como la conductividad eléctrica, determinación de la osmolaridad, cristalización del sudor) solo son aceptables como screening, no para el diagnóstico.
El test se debe realizar por personal experimentado en la técnica. El test cuantitativo de iontoforesis por pilocarpina tiene tres fases:
- Estimulación del sudor. Se lava el antebrazo con agua destilada. Se colocan 2 electrodos, con un reactivo de pilocarpina, en el brazo del paciente, que aplican una corriente de 1,5 mA durante 5 min, controlada de manera automática. Al final de la estimulación, se quitan los electrodos, se lava de nuevo la piel con agua destilada y se seca. La zona de la piel donde se realiza debe estar sana, sin procesos inflamatorios y/o infecciosos. Existe un riesgo pequeño de urticaria en la zona, irritación o quemadura (si se sobrepasa un voltaje de 4 mA o por mal estado de los electrodos), que ocurre en < 1% de las pruebas realizadas.
-
Recogida de la muestra. Se puede realizar con el método clásico de Gibson y Cook, a través de un papel de filtro o gasas prepesados, o sistema denominado Macroduct®. La muestra mínima de sudor debe de ser de 75 mg con el método clásico o 15 µl con Macroduct®. Esta cantidad debe obtenerse en media hora de recogida, pues su prolongación, para aumentar el tamaño de la muestra, se asocia al riesgo de falsos negativos, por proceder de glándulas estimuladas subóptimamente.
-
Análisis de la muestra. La muestra se debe analizar, determinándose la concentración de cloro por la titulación del cloruro de plata. La concentración de sodio se puede analizar mediante fotómetro de llama.
Un valor de cloro > 60 mmol/L tiene una sensibilidad y especificidad cercanas al 100% para el diagnóstico de FQ. Expresado de otra manera, el 98-99% de los pacientes con FQ tienen test del sudor con valores de cloro > 60 mmol/L, 1-2% tiene valores entre 40-60 mmol/L y menos de 1/1.000 pacientes con FQ tienen valores 40 mmol/L.
En los lactantes, los valores de cloro en sudor son menores, y 40 mmol/L representa aproximadamente 3 desviaciones estándar por encima de la media para este grupo de edad, por lo que los últimos consensos consideran dudoso el test a partir de 30 mmol/L en lactantes (menores de 6 meses). Valores por encima de 160 mmol/L aconsejan repetir la prueba, porque son sugestivos de errores de laboratorio.
La sensibilidad y la especificidad de los valores de la medición de sodio son menores, especialmente en adultos, ya que los niveles de sodio en sudor aumentan con la edad. De todas formas, se consideran como positivos niveles de Na > 60 mmol/L, y en pacientes con valores de cloro dudosos, una relación entre Cl/Na > 1, se considera muy indicativa de FQ.
Falsos negativos en el test del sudor se pueden dar también en pacientes con edema.
Se ha señalado la posibilidad de falsos positivos -generalmente basados en muy escaso número de observaciones- en una serie de entidades, cuyas manifestaciones son muy diferentes a las de la FQ, no suponiendo habitualmente ningún problema diagnóstico . La gran mayoría de las causas de falsos negativos y positivos en el test del sudor son metodológicas. La contaminación de la muestra, especialmente en niños con piel atópica, por no seguir meticulosamente el protocolo de lavado, limpieza y secado de la piel, antes y después de la iontoforesis, la utilización de otros métodos para la recogida del sudor, solo aceptables como screening, o el análisis únicamente de la conductividad eléctrica del sudor y/o de la concentración de sodio, son frecuentes fuentes de error.
Las causas que pueden alterar los resultados del test, produciendo falsos positivos o negativos, se encuentran en esta tabla:
| Falsos Positivos | Falsos Negativos |
| Seudohipoaldosteronismo congénito | Edema de la zona estimulada |
| Insuficiencia suprarrenal no tratada | Hipoproteinemia |
| Hipotiroidismo no tratado | Recién nacido en primeros días |
| Dermatitis atópica | Errores técnicos |
| Síndrome nefrótico | |
| Síndrome de Down | |
| Anorexia nerviosa | |
| Sida | |
| Malnutrición proteico-calórica | |
| Hipoparatiroidismo | |
| Síndrome de Klinefelter | |
| Mucopolisacaridosis tipo I | |
| Diabetes insípida nefrogénica | |
| Glucogenosis tipo I | |
| Déficit de glucosa-6-fosfato deshidrogenasa | |
| Fucosidosis | |
| Colestasis familiar (enfermedad de Byler) | |
| Síndrome de Mauriac | |
| Infusión de PG E-1 a largo plazo | |
| Hipogammaglobulinemia | |
| Displasia ectodérmica | |
| Disautonomía familiar | |
| Deprivación ambiental (retraso crecimiento psicosocial) | |
| Errores técnicos |
Hay que tenerlas en cuenta a la hora de la interpretación de los resultados.
De todas formas, la mayoría de las causas de falsos negativos y positivos del test son metodológicas, por error o método inadecuado en alguno de los pasos del test.
Hay más de 1.600 mutaciones conocidas, siendo la más frecuente la denominada ∆F508, que afecta aproximadamente al 60-75% de los pacientes. Hasta la fecha, han sido detectadas más de 1.800 mutaciones en el gen CFTR.
La primera en ser identificada fue F508, el hallazgo de dos mutaciones “causantes de enfermedad” permite realizar el diagnóstico, incluso en presencia de un test del sudor normal. Los criterios para que una mutación sea considerada causante de enfermedad, y no un polimorfismo se debe tener en ceunta. El intento de identificación de ambas mutaciones es aconsejable, incluso en pacientes con diagnóstico claro mediante la clínica, y test del sudor para: ratificar el diagnóstico, disponer de esta información para el análisis genético de los miembros de las familias que estén interesados, el diagnóstico prenatal, la predicción de algunos rasgos fenotípicos, sobre todo el estatus pancreático, y la clasificación de los pacientes con vistas a estudios de investigación.
El diagnóstico de la FQ no siempre es sencillo, por más que sea evidente en la mayoría de los casos. Alguno de los factores que continúan suscitando el interés son la persistente ocurrencia de errores diagnósticos, tanto por una metodología inadecuada del test del sudor, como por la existencia ocasional, incluso con metodología adecuada, de “falsos negativos” y “falsos positivos”; y también se han hecho evidentes las limitaciones del estudio genético. Pese a la descripción de más de 1.800 “mutaciones causantes de enfermedad” diferentes en el gen CFTR – cuyo análisis permite catalogar la gran mayoría de los alelos mutantes -, incluso la secuenciación completa de la región codificante del gen, no permite la identificación de ambas mutaciones responsables de la enfermedad en una fracción de los pacientes. Más aún, incluso con ambas mutaciones del gen FQ identificadas, la incertidumbre sobre las consecuencias funcionales de muchas de ellas, y su variable correlación con el fenotipo, la progresiva elucidación de la base genética y funcional de los pacientes cuyas manifestaciones ocupan el extremo leve-atípico del fenotipo FQ, así como el reconocimiento del papel del gen CFTR en otras patologías distintas a la FQ clásica, como las bronquiectasias diseminadas, agenesia congénita bilateral de vasos deferentes (ACBVD), la aspergilosis broncopulmonar alérgica (ABPA) , y la pancreatitis crónica , contribuyen a que el diagnóstico de la FQ siga siendo un tema apasionante, y a veces polémico.
Autor: Dra. María Patricia Gentili- Jefa Área Inmunología – Fares Taie Instituto de Análisis
Fuente: Fares Taie Instituto de Análisis