El síndrome antifosfolipídico (APS) es una condición autoinmune adquirida. Sus implicancias
clínicas son trombosis venosa, arterial o microvascular y/o complicaciones y pérdidas de embarazos. Es importante diagnosticar este síndrome en el contexto de estos problemas de modo de minimizar el riesgo. El APS se diagnostica en pacientes que han padecido trombosis o pérdidas de embarazos con persistencia de anticuerpos antifosfolípidos. Si bien
cualquier parte del sistema venoso puede estar involucrado, la trombosis se asocia más frecuentemente a trombosis venosa profunda de miembros inferiores (DVT) o a embolismo pulmonar (PE).
El diagnóstico de APS se basa en criterios clínicos y biológicos y en la detección de Anticoagulantes Lúpicos (LA). Un Anticoagulante Lúpico es un inhibidor adquirido de la coagulación, constituido por una familia de inmunoglobulinas que interfieren
en las pruebas de laboratorio dependientes de fosfolípidos. Actualmente, se sabe que estos anticuerpos no reaccionan con los fosfolípidos, sino que reconocen epitopes expuestos por diferentes proteínas con alta afinidad por los fosfolípidos, como son la protrombina y la β2 glicoproteína I (β2GPI).
Los 3 hallazgos principales para el diagnóstico de LA son:
- Prolongación de un tiempo de coagulación dependiente de fosfolípidos
- Demostración de la presencia de un inhibidor a través de tests de mezcla.
- Demostración de que el inhibidor es dependiente de fosfolípidos.
La heterogeneidad entre anticuerpos, la variabilidad que existe entre reactivos e instrumentos y la falta de “gold standards” dificultan las estrategias diagnósticas.
Es por esto, que diversos grupos de expertos han establecido guías sobre la detección de LA en el laboratorio, si bien no existe un completo consenso entre ellos. En la actualidad existen las guías publicadas por la Sociedad Internacional de Trombosis y Hemostasia en su
up-date 2009 (ISTH 2009), la del British Committee for Standards in Haematology publicada en 2012 (BCSH 2012) y la más reciente del Clinical and Laboratory Standards
Institute en 2014 (CLSI 2014).
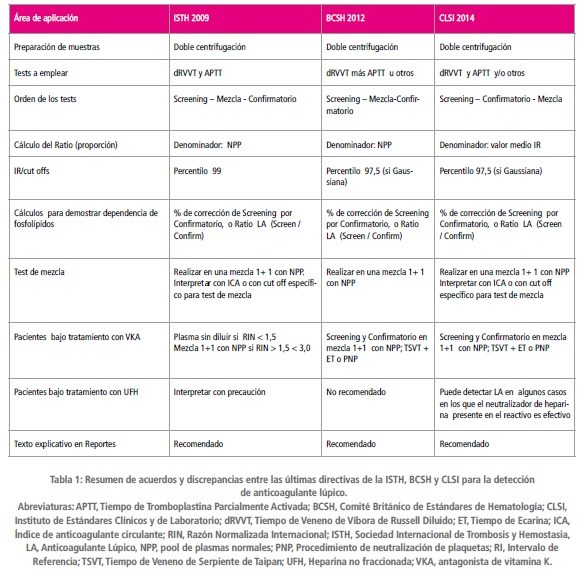
A continuación se presenta un resumen de las diferentes recomendaciones comunes a las diferentes guías, así como también los puntos de discrepancia (Tabla 1).
Variables preanalíticas
La presencia de plaquetas residuales en el plasma puede acortar los tiempos de coagulación y enmascarar la presencia de LAs, en particular si el plasma ha sido congelado y descongelado antes de hacer el test. Existe un completo consenso en que la muestra debe ser recogida con citrato trisódico 109 mM y en que debe ser doblemente centrifugada para obtener un recuento de plaquetas menor a 10 x 109/L.
Intervalos de Referencia/Cut off
Las características de este test requieren la definición local de intervalos de referencia específicos para cada par “reactivo- instrumento”. En general, los intervalos de referencia (IRs) para LA han sido definidos como la Media ± 2DS, pudiendo considerarse el límite superior como el valor “cut off” (percentilo 97,5) por encima del cual se puede hablar de positividad. El valor de la media es el valor a ser empleado para normalizar los “ratios”, es decir, la proporción entre el plasma en estudio y un pool de plasmas normales (NPP).
La ISTH 2009 recomienda el percentilo 99 como valor de cut off lo cual equivale a la media ± 2.3 DS en una población normalsuero mente distribuida. Si bien esto reduce la proporción de falsos positivos aumentando la especificidad de la prueba, inevitablemente origina una pérdida de sensibilidad de la misma. BCSH 2012 y CLSI 2014 se mantienen en la definición de un IR basado en la Media ± 2DS, considerando al valor del percentilo 97.5 como cut off.
El concepto más importante en el que los 3 organismos acuerdan, es que un valor de screening de LA elevado no debe considerarse un falso positivo, sino un tiempo de coagulación alargado que requiere de tests confirmatorios. Debe tenerse en cuenta que, si bien el percentilo 97.5 generará más falsos positivos, el uso del percentilo 99.0 originará más falsos negativos presentando mayor riesgo de una falla en el diagnóstico y tratamiento de los pacientes.
Tests complementarios
Está bien reconocido que un único test no sirve para detectar LAs, sino que se deben usar múltiples ensayos con diferentes principios analíticos. ISTH 2009 advierte sobre la posibilidad de generar mayor número de falsos positivos si se emplea más de un test de screening. Su recomendación es usar el test dRVVT (Tiempo de Veneno de Víbora de Russell diluido) por su especificidad, conjuntamente a un APTT con baja concentración de fosfolípidos por su mayor sensibilidad. CLSI 2014 recomienda el empleo de dRVVT y como test complementario un APTT sensible a LA, no excluyendo la necesidad de algún otros test adicional con diferente metodología. BCSH 2012 también recomienda el dRVVT junto con un reactivo de APTT con sensibilidad probada para LA, un APTT modificado o Tiempo de Protrombina diluido. Si bien ISTH 2009 desaconseja el empleo de Ácido Ellagico como activador, alegando una menor sensibilidad, ha sido demostrado que la falta de sensibilidad de algunos reactivos de APTT se debe a la concentración y composición de fosfolípidos y no al activador presente en el mismo. Por esta razón, ni BCSH 2012 ni CLSI 2014 restringen los reactivos de APTT a ser empleados, en base a su activador.
En síntesis, el test dRVVT es sin duda el método de elección para el screening por su demostrada sensibilidad a los anticuerpos a-β2GPI y por su fuerte correlación con eventos trombóticos. Por otro lado, el APTT es el mejor complemento, debido a su fácil ejecución y bajo costo. No se descarta que en determinadas circunstancias deban emplearse otros tests para tener mayor certidumbre en el diagnóstico.
Tests de mezcla
La ISTH 2009 promueve el uso de los tests de mezcla inmediatamente luego de haber encontrado un test de screening alargado, quedando implícito que el test confirmatorio sólo debe realizarse si la mezcla revela inhibición. BCSH 2012 indica que los tests de mezcla mejoran la especificidad, pero introducen un factor de dilución que puede hacer que la presencia de anticuerpos débiles negativicen la prueba. Ante valores claramente positivos de LA screening y confirmatorios, y pruebas de mezcla negativas, la prueba de LA deben ser considerada positiva. CLSI 2014 modifica el orden de secuencia de los tests en screening-confirmatorio-mezcla. Esta última prueba puede ser omitida si los resultados de las dos primeras son claros y si se han descartado totalmente otras causas que puedan alargar los tiempos de coagulación. En cuanto a la interpretación de los tests de mezcla, el ISTH 2009 da dos opciones; una apunta a establecer un Intervalo de Referencia (IR) específico para la mezcla, que lógicamente será más estrecho que el de los plasmas sin diluir y que tendrá un valor de cut off menor, lo que incrementa la sensibilidad. La segunda alternativa se basa en el cálculo del Índice de Anticoagulante Circulante (ICA), definido por la siguiente expresión:
El índice ICA tiene la ventaja de evaluar los tiempos del plasma relativos al plasma normal en el que fue diluido (NPP). La definición de un cut off específico para plasmas mezcla, en cambio, puede hacerse sólo si se aplica a los ratios. CLSI 2014 apoya este concepto mientras que BCSH 2012 no trata el punto. Sin embargo, no existe método matemático para evaluar resultados de tests de mezcla que pueda discriminar perfectamente entre déficit de factores o presencia de inhibidores, existiendo una gran variabilidad de cut offs entre distintos tipos de tests y reactivos.
Ratios
Para disminuir la variación intra e interensayo, es una práctica común convertir los tiempos para los tests de screening y confirmatorios en ratios (proporciones) empleando el valor de un pool de plasmas normales (NPP). Con esto se compensa la variabilidad que puede existir entre cada par de reactivos screening-confirmatorio. BCSH 2012 ha recomendado esto desde 1991 y ha sido adoptado por ISTH 2009. CLSI 2014 difiere en que recomienda normalizar con el valor medio del IR en lugar de con el de NPP. La razón de esto es que el valor de un mismo NPP puede diferir según el lote de reactivo, por lo tanto si el valor del pool está cerca de un extremo del IR, existirá riesgo de informar un valor falso positivo o negativo.
Tests confirmatorios
Las tres guías coinciden en que los tests confirmatorios para demostrar dependencia de fosfolípidos, deben estar sustentados por un valor anormal en el screening. ISTH 2009 indica que los tests confirmatorios deben tener fosfolípidos en fase hexagonal. BCSH 2012 no especifica el tipo y solo sugiere el empleo de una alta concentración de fosfolípidos, un procedimiento para la neutralización de plaquetas y un reactivo de baja sensibilidad para
LA. CLSI 2014 da más detalles sobre los reactivos confirmatorios recomendados para los diferentes tests de screening. ISTH 2009 recomienda el uso de un nuevo parámetro, porcentaje de corrección del ratio, que permite demostrar o excluir la dependencia de fosfolípidos expresando un porcentaje de corrección del test de screening por el confirmatorio. Viene dado por la siguiente expresión:
BSCH 2012 establece un valor de corrección del 10% como indicativo de presencia de LA mientras que ISTH 2009 recomienda que este valor sea definido localmente. CLSI 2014 ofrece diferentes alternativas según el ensayo empleado; para dRVVT propone un ratio entre los valores de screening y confirmatorio normalizados, siendo un valor mayor a 1.2 indicativo de la presencia de LAs. Los tres organismos coinciden en que ambas expresiones son alternativas válidas.
Pacientes anticoagulados – antagonistas de la vitamina K
Los tres organismos coinciden en que la búsqueda de LAs en pacientes anticoagulados con antagonistas de vitamina K (VKA) o con dosis terapéuticas de Heparina no fraccionada (UFH), requeriría la suspensión de estas drogas por un considerable lapso de tiempo, hecho no siempre factible de realizar, por el riesgo que puede ocasionar en el paciente.
ISTH 2009 indica que dRVVT y APTT pueden ser realizados en plasmas sin diluir, si los valores de RIN son menores a 1.5. Para pacientes con valores de RIN entre 1.5 y 3.0 deben agregarse los tests de mezcla bajo consideración del posible efecto de dilución que estos tests conllevan. Los otros dos organismos recomiendan realizar tests de screening y confirmatorios en plasmas diluidos 1+1 en NPP, pero no lo restringen a plasmas con valores de RIN inferiores a 3.0, sosteniendo que una adecuada interpretación de los mismos puede revelar presencia de LAs aún en muestras con RIN superiores a 3.0. Al mismo tiempo, advierten que un valor negativo del test de mezcla en estos pacientes no debe descartar la presencia de LAs, debido al efecto de dilución. CLSI 2014 no recomienda los tests en plasmas sin diluir por el riesgo de falsos positivos y negativos. Estos dos documentos proponen el Tiempo de veneno de víbora de Taipan como un test de screening secundario acompañado de un Tiempo de Ecarina o neutralización de plaquetas (PNP) como tests confirmatorios.
Pacientes anticoagulados – Heparina
Mientras ISTH 2009 y CLSI 2014 recomiendan cautela al interpretar los resultados en pacientes que están recibiendo heparina no fraccionada (UFH), BSCH 2012 directamente lo desaconseja por la posibilidad de obtener resultados erróneos. CLSI 2014 brinda más detalles sobre la acción de los neutralizantes que contienen muchos reactivos dRVVT comerciales, que solo son efectivos hasta determinados niveles de heparina. La heparina de bajo peso molecular (LMWH) tiene menor efecto sobre los tests LA y los neutralizantes presentes en los reactivos tienen mayor cobertura a dosis profilácticas.
Modo de Informar
Las tres guías establecen que todos los resultados numéricos deben ir acompañados de un texto explicativo que indique si los hallazgos son consistentes con la presencia o ausencia de LA. También recomiendan la repetición de los estudios en un tiempo no mayor a 12 semanas cuando se han obtenido resultados positivos.
Autor: Laura González. Centro de Investigación y Biotecnología – Wiener Laboratorios SAIC, Rosario – Argentina
Fuente: NotiWiener