Presentación de un caso
Una mujer de 34 años se presenta a la consulta externa de la clínica de endocrinología, 4 meses después del parto. Ella dice que desde hace 2 meses siente palpitaciones, intolerancia al calor y dificultad para dormir. Su médico de atención primaria le diagnosticó tiroiditis posparto, después que los análisis de laboratorio revelaron un marcadísimo descenso del nivel de tirotrofina (hormona estimulante del tiroides, TSH) de 0,005 µUI/ml (rango de referencia 0,4-5,5), y que su nivel de tiroxina libre (T4) era elevado, 2,4 ng/dl (rango de referencia 0,7-1,8).
Se le prescribió atenolol como tratamiento sintomático. A las 6 semanas, las pruebas de seguimiento mostraron que su nivel de TSH había aumentado, pero aún así seguía siendo bajo, 0,085 µUI/ml, y su nivel de T4 libre había descendido a 0,6 ng/dL. La paciente fue derivada a un endocrinólogo para su posterior gestión. ¿Cómo se debe continuar la evaluación de esta paciente y cuál es su tratamiento?
Puntos clave
- Un valor de TSH bajo siempre debe dar lugar a la medición de las hormonas tiroideas, es decir, tiroxina (T4) y triiodotironina (T3).
- Los niveles séricos de hormonas tiroideas libres deben utilizarse para interpretar el hallazgo de un nivel de TSH anormal, especialmente en el contexto agudo y de hospitalización.
- Un nivel de TSH bajo no siempre es el resultado de la supresión debida a las elevaciones de las hormonas tiroideas circulantes.
- Un nivel de TSH bajo con niveles normales de hormonas tiroideas libres siempre debe ser reevaluado en 4 a 6 semanas, antes de hacer un diagnóstico.
- El hipertiroidismo manifiesto se asocia generalmente con una TSH francamente suprimida (<0,1 µUI/ml).
La TSH baja tiene muchas causas
Un nivel bajo de TSH sérica, es decir <0,4 µUI/ml (µUI/ml = mU/ml = mUI/l = mU/l) puede resultar de diversas condiciones, las que deben estar incluidas dentro del diagnóstico diferencial, y no solo del hipertiroidismo manifiesto o el hipertiroidismo subclínico. Para hacer el diagnóstico etiológico correcto, la paciencia es una virtud.
Seguimiento del hallazgo de TSH baja mediante la medición de la T4 libre y la T3 libre
El hallazgo de un nivel de TSH bajo siempre debe ser objeto de un seguimiento mediante la medición de las hormonas tiroideas, es decir, T4 y triiodotironina (T3).
Para interpretar un valor de TSH anormal se deben utilizar los niveles de T4 libre y T3 libre y no los niveles totales. Esto se aplica especialmente en los pacientes agudos e internados, entre quienes hay muchos que están desnutridos y en consecuencia tienen niveles bajos séricos de tiroglobulina unida a la albúmina.
En esta situación, los niveles totales de T4 y T3 pueden estar bajos y no representar precisamente el estado tiroideo verdadero. Del mismo modo, en las mujeres embarazadas o que están tomando anticonceptivos con estrógenos, los niveles de T4 y T3 total pueden estar elevados, secundariamente al aumento de la síntesis de tiroglobulina, pero la T4 libre y la T3 libre son normales (en ausencia de un proceso patológico).
Sin embargo, dependiendo del método analítico, las mediciones de las hormonas libres pueden verse afectadas por los cambios en las proteínas que se producen durante las enfermedades graves o el embarazo. Por otra parte, algunos medicamentos pueden afectar los niveles de hormonas libres, por el desplazamiento que sufren las hormonas en su unión a las proteínas.
La mayoría de los laboratorios comerciales calcula los niveles de las hormonas tiroideas libres mediante métodos indirectos. A falta de una medición directa de las hormonas tiroideas mediante diálisis de equilibrio y ultrafiltración (patrón oro), ninguna prueba o ensayo posee un 100% de confiabilidad. Incluso la determinación de los niveles de las hormonas libres puede ser defectuosa si el ensayo es poco fiable. Algunos médicos todavía prefieren el índice tiroideo libre y la captación por resina de T3 o T4 para evaluar la T4 libre, y la T3 total para evaluar el estado de T3.
También se debe tener en cuenta el grado de supresión de la TSH. Un nivel de TSH francamente suprimido (<0,1 µUI/ml) favorecería la tirotoxicosis manifiesta en un contexto clínico correcto (es decir, si los niveles de T4 libre, T3 libre o ambos son normales o elevados)
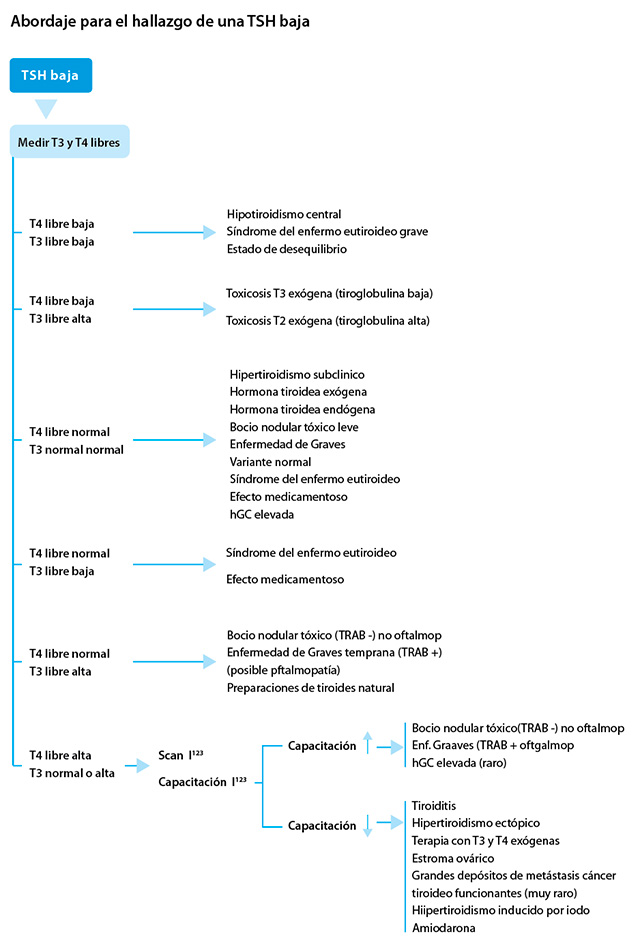
Abordaje para el hallazgo de una TSH baja
Para el diagnóstico y el tratamiento es importante considerar la historia del paciente, observar los signos o síntomas de la enfermedad tiroidea (hipertiroidismo o hipotiroidismo) y preguntar acerca de la exposición a medicamentos. Por otra parte, para confirmar al diagnóstico es muy útil repetir las pruebas de la función tiroidea (y comparar sus resultados con los anteriores) para observar la evolución con el tratamiento al arribar a un diagnóstico.
TSH, T4 libre y T3 libre bajas
La historia de la enfermedad actual (especialmente si se prolonga y es crítica), la revisión de las pruebas de la función tiroidea anteriores y, a veces, la evaluación completa del resto del eje hipotálamo-hipófisis son esenciales para la interpretación correcta de esta combinación de pruebas de la función tiroidea. Se requiere criterio clínico y se justifica la derivación a un endocrinólogo. Los diagnósticos posibles son:
Hipotiroidismo central. Un nivel bajo de TSH no siempre se debe a la supresión causada por los niveles elevados de la hormona tiroidea u otras condiciones. Si el nivel de la hormona tiroidea es bajo, un valor bajo de TSH puede ser el resultado de un proceso central (hipotalámico o hipofisario, o ambos).
Síndrome de enfermedad eutiroidea grave (también denominada “enfermedad no tiroidea” o “síndrome de T3 baja”). En esta condición, el nivel de T3 libre suele ser bajo, y en los casos graves, el nivel de T4 libre también puede estar bajo.
Estado de desequilibrio: se ve en la fase hipotiroidea de la resolución de la tiroiditis.
TSH y T4 libre bajas, T3 libre elevada
Toxicosis, T3 de origen exógeno. La combinación de niveles de TSH, y T4 libre bajos con niveles de T3 libre elevados coincide con la ingestión de dosis supraterapéuticas de T3 exógena, es decir, liotironina. Rara vez se utiliza la terapia con T3 sola para tratar el hipotiroidismo. Una excepción es en los pacientes que suspenden la hormona tiroidea antes del tratamiento con iodo radiactivo, después de haber sido sometidos a la tiroidectomía total por cáncer diferenciado de tiroides.
Cuando se hace tratamiento con T3, a menudo se administra en combinación con T4, ya sea como levotiroxina o como parte de una preparación de tiroides natural T4-T3 derivada del tejido tiroideo porcino. Las preparaciones de tiroides natural pueden contener grandes cantidades de T3, y cuando se administra en dosis supraterapéuticas dar lugar a un perfil similar (TSH baja, T4 libre baja y T3 libre elevada). Sin embargo, el nivel de T4 libre está generalmente en el rango normal porque las preparaciones también contienen T4.
Toxicosis, T3 de origen endógeno
A veces, la glándula tiroides produce grandes y desproporcionadas cantidades de T3, usualmente en un nódulo autónomo. Aunque en esta situación el nivel de T4 libre puede ser bajo, por lo general está en el rango normal. Para ayudar a determinar el origen del exceso de T3 se puede analizar la tiroglobulina sérica exógena (en cuyo caso el nivel de tiroglobulina es bajo) o endógeno (donde el nivel de tiroglobulina es elevado). Si es endógeno, el paciente debe ser derivado a un endocrinólogo para su posterior evaluación.
TSH baja, T4 libre normal y T3 libre normal
Hipertiroidismo subclínico. El hipertiroidismo subclínico se define por un nivel de TSH bajo, T4 libre normal y niveles normales de T3 libre. Los síntomas del hipertiroidismo (fatiga, insomnio, pérdida de peso, palpitaciones, temblor, o intolerancia al calor) generalmente influyen en la decisión de tratar, pero no en el diagnóstico de hipertiroidismo subclínico. Para hacer el diagnóstico correcto es importante confirmar que los resultados de las pruebas en los meses siguientes persisten con el patrón mencionado.
Tirotoxicosis exógena. Esta afección es por lejos la forma más común de hipertiroidismo subclínico y resulta de la ingestión de levotiroxina (T4) o liotironina (T3), o ambas, ya sea por un exceso terapéutico involuntario en pacientes con hipotiroidismo o en dosis intencionalmente elevadas para suprimir la TSH en pacientes con el antecedente de cáncer diferenciado de tiroides.
Tirotoxicosis endógena. El hipertiroidismo subclínico de origen endógeno es el resultado de un proceso fisiopatológico subyacente, que también es responsable del estado de hipertiroidismo manifiesto (por ej., enfermedad de Graves, enfermedad tiroidea nodular tóxica).
La evolución del hipertiroidismo subclínico endógeno depende de la causa subyacente y del grado de supresión de la TSH. Se calcula que anualmente el 5% de los casos de hipertiroidismo subclínico secundario a un bocio multinodular progresa al hipertiroidismo manifiesto, pero un estudio informó que en los pacientes con enfermedad nodular tiroidea y niveles de TSH ≤0,1 µUI/ml, la progresión al hipertiroidismo manifiesto fue aproximadamente el 10% de pacientes por año.
El riesgo de progresión de la enfermedad de Graves subclínica al hipertiroidismo manifiesto ha sido difícil de estimar, dada la naturaleza recurrente y remitente de la enfermedad. Rosario reportó que en 15 (40%) pacientes que tenían niveles de TSH <0,1µUI/ml, la enfermedad de Graves subclínica progresó al hipertiroidismo manifiesto en 2 años, pero no así en los pacientes con niveles de TSH de 0,1 a 0,4 µUI/ml. Estos pacientes fueron <65 años.
En un grupo de pacientes de ≥60 años con hipertiroidismo subclínico endógeno y un nivel de TSH entre 0,1 y 0,4 µUI/ml, Rosario halló que la progresión al hipertiroidismo manifiesto fue poco frecuente (aproximadamente el 1% de pacientes por año). Por lo tanto, para controlar la progresión de la enfermedad, es importante volver a evaluar periódicamente la función tiroidea. Las pruebas de la función tiroidea en los pacientes con hipertiroidismo subclínico son importantes, especialmente en aquellos con valores de TSH francamente suprimidos (<0,1 µUI/ml).
Los resultados adversos asociados al hipertiroidismo subclínico son las arritmias cardiacas, principalmente la fibrilación auricular, y la pérdida acelerado de la densidad mineral ósea. Cooper señala que el tratamiento definitivo (ablación con iodo radiactivo, medicamentos antitiroideos o cirugía) “parece razonable” para los pacientes >60 años con un nivel de TSH <0,1 µUI/ml y para ciertos pacientes de alto riesgo con niveles de TSH de 0,1 a 0,4, por ejemplo, aquellos con antecedentes de enfermedad cardíaca, osteoporosis o síntomas de hipertiroidismo.
Variantes normales
El rango normal de TSH se define como el valor medio en la población general +/- 2 desviaciones estándar. Esta gama incluye al 95% de la población, por lo que el 2,5% de las personas tiene un nivel superior a este rango, y otro 2,5% tienen un nivel inferior. Pero algunas personas con niveles más bajos de TSH, especialmente en el intervalo de 0,1 a ,4 µUI/ml (3 desviaciones estándar por debajo de la media), en realidad son eutiroideos.
Estas personas históricamente han sido catalogadas como portadoras de hipertiroidismo subclínico, ya que no hay modo de diferenciar a estas personas eutiroideos “normales” de las personas con hipertiroidismo subclínico asintomático. Necesitan estar bajo un seguimiento ya que pueden tener un hipertiroidismo subclínico verdadera, y la posibilidad de presentar síntomas en el futuro, que deberán ser tratados.
Síndrome del enfermo eutiroideo
El síndrome del enfermo eutiroideo es común durante las enfermedades críticas. Sin embargo, la enfermedad tiroidea es común en la población general y, a menudo, el médico no cuenta con los resultados de las pruebas funcionales previas a la aparición de una enfermedad crítica, que los ayuden a diferenciar la enfermedad tiroidea manifiesta del síndrome del enfermo eutiroideo.
Por otra parte, a menudo los pacientes no pueden proporcionar una historia (o relacionar sus síntomas) de enfermedad tiroidea manifiesta, lo que torna difícil interpretar las pruebas anormales de la función tiroidea durante su internación hospitalaria. Para interpretar correctamente los resultados anormales que aparecen es muy valioso conocer los valores anteriores.
Los valores de las pruebas de función tiroidea en el síndrome del enfermo eutiroideo pueden variar, dependiendo de la gravedad de la enfermedad. Una T3 libre baja con T4 libre normal y TSH normal-baja son las anormalidades más comunes que se observan en el síndrome del enfermo eutiroideo. El nivel de T3 libre es bajo debido a la disminución de la conversión periférica de T4 a T3 durante la enfermedad crítica. Sin embargo, el síndrome del enfermo eutiroideo se puede presentar con un espectro de pruebas de la función tiroidea anormal, que complica la interpretación y el diagnóstico.
Los niveles séricos de la TSH son normales en aproximadamente el 50% de los pacientes con enfermedad no tiroidea, bajos en el 30% y elevados en el 12%. No obstante, la franca supresión de la TSH sérica (<0,1 µUI/ml) solo se observó en casi el 7% de los pacientes, principalmente en aquellos cuyo cuadro clínico fue confundido por la acción de los medicamentos (dopamina o corticosteroides, o ambos) cuyos efectos son independientes de los efectos de la TSH baja.
Medicamentos que suprimen la TSH
Muchos fármacos usados en el hospital y las unidades de terapia intensiva pueden alterar las pruebas de la función tiroidea, independientemente de la enfermedad sistémica que complica el cuadro clínico.
Glucocorticoides. Se ha demostrado que en dosis elevadas, los corticosteroides suprimen la TSH sérica en forma transitoria.
Octreotida. Este fármaco, como así otros análogos de la somatostatina, también suprimen transitoriamente la TSH. Sin embargo, estos medicamentos (y los glucocorticoides) no parecen provocar hipotiroidismo central.
Dopamina. Administrada en dosis farmacológicas durante un tiempo prolongado disminuyen el nivel de la TSH sérica, tanto en las personas enfermas como en las sanas
Dobutamina. En dosis farmacológicas reducen los niveles de TSH, aunque se observó que en aquellos con un valor basal de TSH normal, el nivel de TSH sérica permaneció dentro de los límites normales.
Amiodarona. Aunque la mayoría de los pacientes que toman amiodarona permanecen eutiroideos, el fármaco puede causar hipotiroidismo o hipertiroidismo. Al principio, la amiodarona generalmente provoca una disminución del nivel de T3 mediante la inhibición de la 5′-deiodinasa, con el aumento recíproco transitorio de la TSH. Cuando la amiodarona induce la tirotoxicosis, la condición puede ser subclínica, manifestada por un nivel bajo de TSH en presencia de niveles normales de hormonas tiroideas o, tirotoxicosis, manifestada por una TSH baja y niveles elevados de hormonas tiroideas. A menudo, los pacientes que toman medicamentos que disminuyen la TSH suelen estar críticamente enfermos y pueden tener un componente del síndrome del enfermo eutiroideo, lo que resulta en un panorama mixto.
Gonadotrofina coriónica humana elevada
La subunidad α de la gonadotrofina coriónica humana (hCG) es homóloga a la subunidad α de la TSH. Por lo tanto, la concentración elevada de hCG estimula levemente la actividad de la glándula tiroides. La concentración de hCG sérica es más elevada en el primer trimestre del embarazo y la actividad estimulante de la glándula tiroides de la hCG puede suprimir el nivel de TSH sérica, pero en la mayoría de los casos, ese nivel se mantiene dentro del “rango normal” del embarazo.
Los niveles de hCG observados durante el primer trimestre del embarazo suelen asociarse a un nivel bajo de TSH y niveles de hormonas tiroideas libres normales. En las embarazadas que no están en tratamiento con T4 para el hipotiroidismo, una TSH persistentemente suprimida (<0,1 µUI/ml) después del primer trimestre o elevaciones de las hormonas tiroideas libres en cualquier momento del embarazo indican que la TSH está suprimida secundariamente por una función tiroidea autónoma, como sucede en la enfermedad de Graves y el bocio nodular tóxico, lo que requiere mayor investigación.
Durante el embarazo están prohibidos los estudios de imágenes con radioisótopos. Si la concentración de hCG es marcadamente elevada y prolongada, como sucede en la hiperémesis gravídica y la enfermedad trofoblástica gestacional (mola hidatiforme, una condición benigna y, el coriocarcinoma, una condición maligna), se puede desarrollar un hipertiroidismo manifiesto, con T4 y T3 libres elevadas.
TSH baja, T4 libre normal, T3 libre baja
Síndrome del enfermo eutiroideo y/o el efecto medicamentoso. Cuando el nivel de TSH es bajo, secundario al síndrome del enfermo eutiroideo o a un medicamento, o ambas cosas, el nivel de T3 libre generalmente también está bajo, y puede estar exclusivamente relacionado con un componente del síndrome del enfermo eutiroideo, o ser secundario a medicamentos, como los corticosteroides y la amiodarona, que inhiben la conversión de T4 a T3.
TSH baja, T4 libre normal, T3 libre elevada
Bocio nodular tóxico vs. enfermedad de Graves temprana. Si la T3 libre está elevada y la TSH es baja (suprimida), incluso en ausencia de síntomas, estaría descartado el hipertiroidismo subclínico, ya que, por definición, para arribar a tal diagnóstico la T4 libre y los niveles de T3 libre deben ser normales.
Las posibilidades diagnósticas son el bocio nodular tóxico y la enfermedad de Graves temprana. La combinación de T3 elevada, TSH suprimida y T4 normal se asocia generalmente al bocio nodular tóxico, mientras que en la enfermedad de Graves la T3 y la T4 están típicamente tanto elevadas (aunque la T3 suele estar más elevada que la T4).
Se deben tomar imágenes con I123 (“scan y análisis de la captación del iodo “). La absorción difusa del I123 apoya el diagnóstico de enfermedad de Graves; la presencia de áreas irregulares y nodulares con aumento de la captación de I123 avala el diagnóstico de bocio nodular tóxico. También se deben investigar ambos anticuerpos del receptor de TSH (TRAB), estimulantes y bloqueantes, que son muy específicos de la enfermedad de Graves.
Preparaciones tiroideas naturales
Las preparaciones de tiroides natural, que pueden contener grandes cantidades de T3, también pueden dar lugar a la combinación de T4 libre normal y T3 libre elevada. Dado que estas preparaciones contienen T4 y T3, al ser administradas en dosis supraterapéuticas suelen dar como resultado una TSH baja, T4 libre normal y niveles de T3 libre elevados. Sin embargo, si estos preparados se toman en cantidades suficientemente grandes, tanto la T4 libre como la T3 libre pueden estar elevadas. Esto contrasta con la monoterapia supraterapéutica con T3 (liotironina), que por lo general da como resultado TSH baja, T4 libre baja y T3 libre elevada.
TSH baja, T4 libre elevada, T3 libre normal o elevada
Si el nivel de T4 libre es elevado, el nivel de T3 libre generalmente también está elevado. Se deben tomar imágenes con I123.
Si la captación de I123 es elevada
Enfermedad de Graves vs. bocio nodular tóxico. Si la absorción de I123 es elevada, y el nivel de TSH es bajo (suprimida) junto con la elevación de las hormonas tiroideas libres. Esta combinación aparece en el hipertiroidismo manifiesto secundario a la función autónoma de la glándula tiroides (TSH-independiente). Los pacientes con enfermedad de Graves suelen tener TRAB positivos y pueden tener la oftalmopatía relacionada mientras que los pacientes con bocio nodular tóxico son-TRAB negativos y no sufren la oftalmopatía de Graves.
Los pacientes con enfermedad de Graves o bocio nodular tóxico tienen mayor captación de I123; Sin embargo, el patrón de captación en la enfermedad de Graves es difuso mientras que en el bocio nodular tóxico es irregular o nodular. Si hay complicaciones, el patrón de captación en la enfermedad de Graves puede ser irregular, por ej., cuando el paciente ha sido tratado con fármacos antitiroideos como el propiltiouracilo o el metimazol. Es importante constatar si el paciente ha recibido una carga de iodo (por ej., un medio de contraste intravenoso iodado) ya que puede empeorar transitoriamente la tirotoxicosis al mismo tiempo que ocasiona una absorción baja del I123.
La razón de la captación baja es que la glándula se satura con el “iodo frío” (no radioactivo) del medio de contraste y no puede ocupar más iodo (radiomarcado) para la gammagrafía. Por esta razón, no se deben realizar imágenes con I123 si no han pasado 6 a 8 semanas de una carga exógena de iodo. En estas circunstancias se deben utilizar la historia y el examen físico así como las pruebas de laboratorio (TRAB).
Gonadotrofina coriónica humana elevada. Está contraindicado realizar imágenes con I123 a las embarazadas. Por lo tanto, todas las mujeres en edad fértil deben hacerse un test de embarazo antes de someterse a la realización de imágenes con radioisótopo. Si se sospecha la tirotoxicosis de de la hCG (por ej., en los casos de mola hidatiforme o coriocarcinoma), antes de indicar la realización de imágenes con radioisótopo se debe hacer una ecografía uterina para descartar un embarazo viable.
Opciones terapéuticas. Para las causas habituales de hipertiroidismo (bocio nodular tóxico o enfermedad de Graves) se utiliza la ablación con iodo radiactivo (a menos que el paciente haya estado expuesto a una reciente carga de iodo frío), medicamentos antitiroideos (metimazol o propiltiouracilo) o resección quirúrgica (parcial o tiroidectomía total).
Los pacientes con hipertiroidismo manifiesto deben ser derivados a un endocrinólogo para una completa evaluación diagnóstica y el tratamiento disponible. Los bloqueantes ß pueden ser utilizados para mejorar los síntomas de tirotoxicosis como las palpitaciones, la ansiedad y el temblor.
Si la absorción de I123 es baja
Un nivel bajo de TSH (suprimida) junto con elevaciones de las hormonas tiroideas libres y una absorción baja de I123 es consistente con el hipertiroidismo manifiesto secundario a:
- Tiroiditis
- Hipertiroidismo ectópico debido al tratamiento conT4-T3, estroma ovárico (muy raro) o, grandes depósitos de metástasis de cáncer de tiroides funcionantes (muy raro).
- Hipertiroidismo inducido por iodo (efecto Jod-Basedow)
- Tirotoxicosis inducida por amiodaronaTiroiditis. Es la destrucción o la inflamación del tejido tiroideo con la posterior liberación a la circulación de las hormonas de tiroides preformadas, dando como resultado la tirotoxicosis. La gravedad y la duración de la tirotoxicosis no dependen solo del tamaño de la glándula tiroidea dañada y del almacenamiento de las hormonas tiroideas preformadas sino también de la extensión y duración de la destrucción y los daños tiroideos. La tiroiditis subaguda suele durar varias semanas a algunos meses, y por lo general sigue un patrón de:
- Hipertiroidismo transitorio debido a la liberación de las hormonas tiroideas almacenadas.
Un breve período de eutiroidismo. - Hipotiroidismo, dado que el depósito de hormonas tiroideas preformadas está agotado y la inflamación y la destrucción se atenúan para después producirse la
- Recuperación (en general, a menos que la tiroides no sea capaz de recuperarse), durante la cual el nivel de TSH se eleva en respuesta a los niveles bajos de las hormonas tiroideas en la circulación; en la recuperación, la tiroides comienza a reanudar la síntesis de hormonas tiroideas. Hay un breve período durante la fase hipotiroidea de la tiroiditis durante el cual el nivel de TSH se mantiene bajo (o inapropiadamente normal) a pesar de que los niveles de las hormonas tiroideas libres también están bajos; este período es comúnmente denominado “estado de desequilibrio”). Este estado se debe a la lenta recuperación de los tirotrofos hipofisarios, ya que ellos escapan a la supresión tónica por exceso de hormonas tiroideas.
La entidad clásica tiroiditis De Quervain (tiroiditis granulomatosa subaguda) es dolorosa mientras que otras formas son indoloras (por ej., tiroiditis linfocítica autoinmune, tiroiditis post-parto o, tiroiditis relacionada con las citocinas [interferón] o la terapia con litio). Otras formas de tiroiditis que pueden o no ser dolorosas son las tiroiditis inducidas por la amiodarona, la radiación o el trauma.
Independientemente de la causa, se hace una espera vigilante mientras se monitorea la función tiroidea, con el fin de asegurar que se produce la recuperación. Los bloqueantes ß se utilizan a menudo para disminuir los síntomas durante el estado de hipertiroidismo transitorio observado en la evolución de la tiroiditis.
Hipertiroidismo ectópico
La ingestión exógena de T4, T3, o ambas puede suprimir la función tiroidea. Esto puede ocurrir con dosis supraterapéuticas de T4 y T3 (por lo general para el hipotiroidismo) y también artificialmente o en pacientes que abusan de los medicamentos para bajar de peso. Una forma útil para diferenciar las causas exógenas de la tirotoxicosis de las causas endógenas es medir la tiroglobulina sérica, que estaría disminuida en la primera y elevada en esta última.
La producción ectópica de T4 y T3 puede ocurrir, aunque raramente, como en los casos de estroma ovárico o en los pacientes con grandes depósitos de metástasis de cáncer de tiroides funcionantes. El estroma ovárico es un teratoma de ovario muy raro (1% de todos los tumores de ovario) que incluso, cuando está presente, no suele provocar tirotoxicosis. Sin embargo, el diagnóstico debe ser considerado en el contexto clínico adecuado, es decir, en el contexto de tirotoxicosis y tumor pélvico; en estos casos, la captación de iodo radiactivo debería estar elevada en la pelvis.
Del mismo modo, la tirotoxicosis secundaria a las metástasis del cáncer de tiroides funcionantes es también poco frecuente pero debe tenerse en cuenta en el contexto clínico adecuado (tejido- ávido de iodo en las imágenes nucleares con iodo radiactivo de todo el cuerpo).
Hipertiroidismo inducida por iodo. Se desarrolla en pacientes con enfermedad tiroidea subyacente (bocio nodular tóxico o enfermedad de Graves) y está causado por una exacerbación autónoma (TSH-independiente) de la función tiroidea por una carga de iodo (por ej., un medio de contraste iodado por vía intravenosa o, tratamiento con amiodarona)
Tirotoxicosis inducida por amiodarona. En diversos informes, la incidencia de esta tirotoxicosis varió entre el 1% y el 23%; existen dos tipos.
El tipo 1 es una forma de hipertiroidismo inducido por iodo. Puede ocurrir en pacientes con función tiroidea autónoma, cuando están expuestos a la amiodarona, la cual contiene 37% de su peso en iodo.
El tipo 2 se produce en pacientes sin enfermedad tiroidea subyacente y es probablemente una consecuencia de una tiroiditis destructiva inducida por fármacos. También se pueden observar formas mixtas o indeterminadas de tirotoxicosis inducida por amiodarona, las que abarcan varias características de los tipos 1 y 2.
El tratamiento varía según el tipo: fármacos antitiroideos (tionamidas) en el tipo 1 y corticosteroides en el tipo 2. Puede ser difícil discernir entre las dos entidades, y a veces es necesario hacer un tratamiento combinado con fármacos, antitiroideos y prednisona. Luego se retira uno de los fármacos y se supervisa el efecto sobre los niveles de las hormonas tiroideas libres, lo que ayuda a determinar cuál es el medicamento que está actuando, señalando el diagnóstico y el tratamiento correcto.
Fuente: IntraMed