Autora: Ana M. Pertierra
En el Laboratorio de Estructura-Función e Ingeniería de Proteínas en el Fundación Instituto Leloir (FIL), liderado por el Dr. Gonzalo de Prat- Gay e integrado por un equipo de investigadores en su gran mayoría bioquímicos, se estudian las proteínas de ciertos virus, entre ellos las del Virus del Papiloma Humano (VPH). Analizan la estructura conformacional, la actividad y funcionalidad de proteínas clave en tipos oncogénicos del virus.
“En este laboratorio trabajamos con dos tipos de virus: VPH causante del 99% de los cánceres de cuello uterino y del 25% de los orofaríngeos y también con el virus sincicial respiratorio muy importante en pediatría. Son las dos líneas más importantes de investigación que tenemos además de la producción de anticuerpos monoclonales”, cuenta Leonardo Alonso, Doctor en Bioquímica e investigador adjunto del Conicet, autor principal del estudio que el equipo de investigación acaba de publicar en la revista Redox Biology.
Los virus del papiloma humano (VPH) son virus comunes que pueden causar verrugas. Existen más de 100 tipos de VPH. La mayoría son inofensivos, pero aproximadamente 30 tipos se asocian con un mayor riesgo de tener cáncer. Estos tipos afectan los genitales y se adquieren a través del contacto sexual con una pareja infectada. Se clasifican como de bajo riesgo o de alto riesgo. Los VPH de bajo riesgo pueden causar verrugas genitales. En las mujeres, los VPH de alto riesgo pueden conducir al cáncer del cuello uterino, vulva, vagina y ano. En los hombres, pueden conducir al cáncer del ano y del pene. Sin embargo, últimamente está aumentando el número de casos de cáncer orofaríngeo VPH positivos.
“Se estima que más del 80% de la población sexualmente activa ha estado en contacto con el virus”, señala Alonso y –agrega– hay virus del papiloma humano que atacan epidermis y otros mucosas. Dentro de los que atacan mucosas hay dos grandes grupos: los de bajo riesgo, pueden producir una lesión pero nunca cáncer y los de alto riesgo, unas 15 cepas aproximadamente, muy asociadas a la generación de tumores en particular se estima que el 80% de los cánceres están generados por dos cepas , la 16 y la 18 (las utilizadas para la producción de las vacunas profilácticas).
Nosotros –explica el investigador–trabajamos con las cepas 16, 18 (de alto riesgo) y con la 11 que es de bajo riesgo. Es un virus muy pequeño tiene solo 8 kilobases que codifica para 8 a 10 proteínas, una de ellas es la oncoproteína E7 que es con el que nosotros trabajamos.
Los investigadores del FIL encontraron que la oncoproteína viral E7 contiene grupos reactivos que detectan el entorno oxidante de las células y cambian su conformación para adaptarse a un ambiente apropiado para el desarrollo tumoral.
Se sabía que para la replicación del VPH y la transformación celular inducida por el virus se requiere que se expresen las oncoproteínas E6 y E7 de forma persistente y que la infección con VPH oncogénicos induce la desregulación de la homeostasis redox celular.
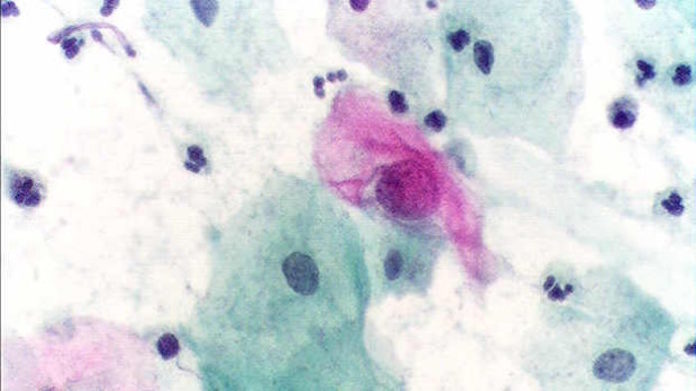
“La oncoproteína E7 es una proteína muy importante porque si bien el virus tiene otras proteínas, como las de la cápside, a excepción de la helicasa, no tiene actividad enzimática por lo que E7 rapta la maquinaria enzimática y de replicación de la célula infectada y desregula el ciclo celular”, explica el científico. El virus –añade– infecta las capas basales pero madura en las capas superficiales (queratinocitos) que son de descamación por eso se pueden ver en los extendidos celulares donde se hace el Papanicolau. Las proteínas E7 y E6 del virus gobiernan la maquinaria de replicación de las células de las capas superficiales infectadas.
Los científicos del Instituto Leloir estudiaron exhaustivamente la proteína E7 y encontraron que tenía unos residuos de cisteína altamente reactivos. Se preguntaron qué función podrían cumplir ya que son residuos aminoácidos que se oxidan con facilidad. Según Alonso, el costo de la célula de vivir en un entorno de oxígeno es que se produce una oxidación que es dañina, sin embargo, la célula tiene una maquinaria enzimática compleja para protegerse de esos efectos de la oxidación. Las células infectadas están en un entorno más oxidante porque el virus desregula esa maquinaria. “Nosotros pudimos establecer lo que se desconocía hasta ahora que la proteína E7 tiene la capacidad de detectar o sensar esos cambios redox del ambiente mediante los residuos aminóacidos de cisteína que están distribuidos o agrupados en la molécula bajo determinados patrones”, explica Alonso. Y –completa–algunas de las cisteínas presentes en la proteína E7 están para unir átomos de Zinc y darle una conformación a la proteína pero el resto no se sabía qué función cumplía. Son altamente reactivas y tienen patrones de distribución diferentes en las distintas cepas de VPH.
Este hallazgo totalmente novedoso abriría el camino hacia el desarrollo futuro de fármacos específicos porque las cisteínas reactivas podrían convertirse en blancos terapéuticos para generar nuevas drogas. Sin embargo, el bioquímico aclara que “entre los hallazgos de la ciencia básica y la aplicación terapéutica práctica hay un largo camino que requiere mucho tiempo e inversión y está plagado de fracasos. Se estima que entre 1000 moléculas estudiadas tan solo una es la que puede llegar al mercado”. Y –destaca– lo que hace la ciencia básica es mostrar las posibilidades de ataque de una proteína o de un camino metabólico, hallar la causa. Al saber cómo funciona el virus y que están presentes estos residuos existe el conocimiento que ofrece nuevas posibilidades.
Metodologías químicas y genómicas
El virus VPH no desarrolla en células aisladas sino que requiere del epitelio estratificado por eso es muy difícil y costoso de cultivar. Los investigadores del FIL no lo cultivan sino que trabajan directamente con el DNA y las proteínas del virus expresadas por ingeniería genética en bacterias.
“Se mandan a sintetizar a una empresa americana los genes de interés para su estudio clonado en un determinado vector y luego nos envían por correo un pequeño papel donde está impregnado el material. Lo reconstituimos en agua y con ese material genético se infectan bacterias donde se lo replica y así tenemos el material para trabajar”, explica Alonso. Y –agrega– una vez obtenidas las proteínas, las purificamos y las estudiamos por técnicas analíticas de HPLC, espectrometría de masa, entre otras. También las ponemos en contacto con la proteína verde fluorescente dentro de una célula eucariota y vemos en función del estrés oxidativo y de poner o sacar residuos a través de técnicas de biología molecular cómo se comporta esa proteína.
Los científicos encontraron que la proteína desarrolló sitios reactivos de modo que cuando se encuentre en un ambiente oxidativo pueda cambiar su conformación y su función. “Las proteínas virales son muy pocas pero hacen múltiples funciones, esos residuos y su oxidación modifican su localización en núcleo o en citoplasma”, señala el investigador. Este trabajo que acaban de publicar les llevó más de dos años y contó con el apoyo del Conicet y el Instituto Nacional del Cáncer, tuvo muy buena repercusión y lo consideran un punto de partida para establecer conexiones con otros centros y colaboraciones en el desarrollo de fármacos.
Prevención
El cáncer de cuello de útero es altamente prevenible. Este tipo de cáncer es casi siempre provocado por algunos tipos del Virus del Papiloma Humano, conocido como VPH. Pero tener el virus no significa que vaya desarrollarse el cáncer. Según datos del INC, se calcula que solo alrededor del 5% de las infecciones por el Virus del Papiloma Humano (VPH) podrían provocar “lesiones” (cambios en las células) que desemboquen a largo plazo en un tumor. Estas lesiones no son dolorosas ni visibles y no producen síntomas. Por eso es importante realizarse los controles ginecológicos, porque solo si la infección persiste sin tratarse, con los años, puede convertirse en un cáncer.
Este virus se transmite muy fácilmente por medio del contacto sexual (con el contacto piel a piel sin necesidad de penetración): se calcula que el 80% de las personas lo tuvieron o tendrán alguna vez, solo que muchas veces no se enteran: en la mayoría de los casos, este virus no alcanza a desarrollarse en el cuello del útero, ya que las lesiones remiten solas. Si bien no suele provocar serios problemas de salud en los hombres, ellos lo contraen de la misma forma que las mujeres.
En la actualidad se conocen más de cien tipos de VPH, que según sus características se dividen en dos grupos: de alto y de bajo riesgo oncogénico. Los virus de bajo riesgo pueden producir lesiones benignas que suelen manifestarse como verrugas genitales (tanto en hombres como mujeres), pero solo los de alto riesgo están asociados a las lesiones precancerosas que, de no ser tratadas, pueden evolucionar a un cáncer de cuello de útero. Dado el lento desarrollo de las lesiones, que pueden tomar entre 10 o 15 años en desarrollarse, se dice que el CCU es altamente prevenible si se realizan los controles ginecológicos.
Con el Test de Papanicolau, es muy sencillo detectar posibles lesiones de manera temprana, y permite que sean tratadas mucho tiempo antes de que puedan convertirse en cáncer.
La vacuna contra el VPH es una herramienta muy eficaz que permite inmunizar contra el cáncer de cuello de útero. El Calendario Nacional de Vacunación contempla la aplicación de dos dosis a todos los niños de 11 años: 1° dosis y la 2° dosis a los seis meses de la primera.
Sin embargo, las autoridades sanitarias recomiendan que incluso las mujeres que se han dado la vacuna deberán realizarse el Papanicolau (PAP) regularmente ya que la vacuna no protege contra todos los tipos de VPH.
“Recientemente se ha incluido a los varones a los 11 años porque está aumentando la incidencia de cáncer de pene y ano en varones. También ha aumentado el cáncer oro-faríngeo VPH positivo. Se estima que es la causa del 25% de dichos cánceres, siendo la primera causa el tabaquismo y alcoholismo”, dijo Alonso.
Las vacunas que se están utilizando están diseñadas con proteínas de la cápside del virus de las cepas 16 y 18 de VPH, las producen el 80% de los cánceres, y son muy seguras porque no tienen material genético.
“No se sabe por qué un individuo desarrolla el cáncer a partir de la infección con VPH y otro no. Por qué un individuo se libra de la infección sin haberse dado cuenta de tenerla, otro se convierte en una infección crónica y otro se hace crónica y degenera en tumor”, sostiene Alonso. Y–prosigue– se sabe que la mera infección no desencadena el tumor sino que se requiere otro evento. Nosotros planteamos que el estrés oxidativo al que está sujeta la célula a lo largo de su vida infectada con el virus sería el evento que desarrollaría el proceso tumoral.
Hijo de una bioquímica federada
Leonardo Alonso es oriundo de Benito Juárez, una localidad del centro bonaerense. Hijo de una pareja de profesionales de la salud, su padre fue médico, su madre, Norma Barone, es una bioquímica federada de Benito Juárez del Distrito VIII al frente de su laboratorio por más de 45 años y próxima a jubilarse.
El Dr. Alonso se recibió de Bioquímico en la en la Facultad de Farmacia y Bioquímica de la UBA en 1998 y se doctoró en 2005 trabajando en el tema de esta proteína del virus VPH.
“Si bien hice un paso por la industria farmacéutica de productos biológicos y me gustaba la bioquímica clínica, siempre me atrajo la investigación”, cuenta el científico. “Considero que la carrera de Bioquímica me ofreció una sólida formación en Química Biológica que fue una ventaja competitiva para mi trabajo de investigación”, concluyó.
Fuente: FABA Informa