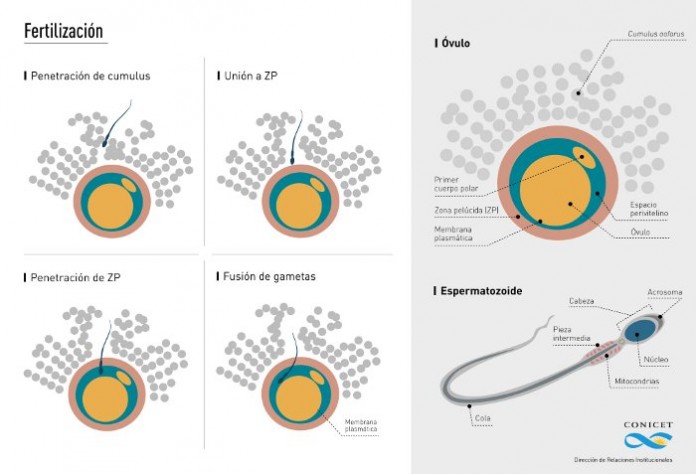
La fertilización es un proceso que involucra la interacción de las gametas femenina y masculina para dar origen a un nuevo individuo. Las células sexuales humanas, ovocito –femenina- y espermatozoide –masculina- son producidas en las gónadas: ovarios y testículos, respectivamente. El espermatozoide que sale del testículo no puede fertilizar al ovocito a pesar de estar estructuralmente completo porque carece de la capacidad de reconocerlo. Esta capacidad la adquiere a medida que transita por el epidídimo, un órgano ubicado en el borde posterior del testículo que consiste en un largo túbulo. Cuando el espermatozoide termina de pasar por él, adquiere la motilidad necesaria para dirigirse al ovocito y la capacidad de reconocerlo y fertilizarlo.
El ovocito, además de poseer la membrana plasmática que tiene cualquier célula, está rodeado por una capa llamada zona pelúcida y por otra envoltura denominada cumulus oophorus. Durante la fertilización, el espermatozoide deber penetrar estas dos envolturas para luego fusionarse con la membrana plasmática, entrar al citoplasma y depositar el material genético. Un grupo de científicos del Instituto de Biología y Medicina Experimental (IBYME, FYBIME-CONICET) estudia los mecanismos moleculares que ocurren en este proceso. La investigación en este aspecto permitirá el desarrollo de nuevas técnicas para un mejor diagnóstico y tratamiento de los problemas de infertilidad humana.
“Aun se conoce poco acerca de lo que pasa dentro de esta caja negra que es el epidídimo. Trabajamos para dilucidar qué hace este órgano para conferirle al espermatozoide la capacidad de reconocer al ovocito, utilizando como modelo las proteínas CRISP (del inglés Proteínas Secretorias Ricas en Cisteínas). Esta es una familia de proteínas evolutivamente muy conservadas desde los hongos hasta el humano, esto indica que cumplen una función importante. Encontramos que la proteína epididimaria CRISP1, primer miembro descripto de esta familia e identificado por nuestro grupo, se une a la superficie del espermatozoide a medida que el mismo transita por el epidídimo y le confiere la capacidad de reconocer a un sitio complementario en el ovocito”, explica Patricia Cuasnicú, investigadora principal del CONICET en el IBYME.
El equipo de Cuasnicú estudia la participación de proteínas CRISP en el proceso de interacción de gametas. En un estudio reciente publicado en la prestigiosa revista The Journal of Cell Biology (JCB) demostraron la presencia de CRISP1 en todo el tracto femenino, incluyendo las células del cumulus oophorus. “Existe una proteína en anfibios llamada alurina que es muy parecida a CRISP1, es secretada por el oviducto, se une a una capa que rodea al ovocito equivalente al cumulus de mamíferos y, además, es quimioatractante de espermatozoides, lo cual es sumamente importante para especies de fertilización externa. Pensamos entonces que quizá existía una CRISP femenina en mamíferos con esas propiedades, que es lo que en este trabajo se demuestra”, aclara la investigadora.
Se llegó a estos resultados mediante estudios de fertilización en un modelo de ratones llamados knockout en los que no está presente el gen que codifica para la proteína que se investiga, en este caso CRISP1. Cuasnicú destaca que si bien los ratones knockout para CRISP1 eran fértiles, los espermatozoides carentes de CRISP1 tenían una menor capacidad de fertilizar al ovocito mientras que los ovocitos que no tenían CRISP1 en el cumulus eran menos penetrados que los que la tenían, lo que indica que CRISP1 es importante para la función de ambas gametas.
El trabajo publicado en JCB muestra un novedoso mecanismo donde CRISP1 tiene un rol quimioatractante de espermatozoides que logra modulando una motilidad muy vigorosa que desarrolla el espermatozoide llamada hiperactividad. Esta motilidad le da la fuerza para penetrar las envolturas que rodean al ovocito. Cuando el espermatozoide contacta con CRISP1 presente en el cumulus durante la fertilización, pierde la hiperactividad para ganar direccionalidad y ser quimioatraído hacia el ovocito.
“Sabiendo que CRISP1 orienta a los espermatozoides, y que tanto la orientación como la hiperactividad son eventos calcio-dependientes, nos preguntamos si CRISP1 estaría regulando a CatSper, el principal canal por el cual entra el calcio a los espermatozoides. A través de una técnica específica que se llama patch clamp, pudimos confirmar que, efectivamente, lo regulaba. ¿Cómo? Inhibiéndolo. CatSper es esencial para la fertilidad porque el espermatozoide que no la tiene no sufre hiperactivación y el individuo es infértil tanto en roedores como en humano”, aclara la investigadora.
Los científicos aseguran que es importante destacar que estos resultados se obtuvieron en el modelo murino por lo que aun deben estudiar si estos fenómenos se repiten en humanos. Hasta el momento, se sabe que hay una proteína equivalente a CRISP1 en los espermatozoides humanos que cumple los mismos roles que en el ratón, pero se desconoce si está presente en el tracto reproductivo de la mujer y sus propiedades. En caso de que así fuera, una posible aplicación sería utilizarla como un seleccionador de los mejores espermatozoides. Aquellos que respondan mejor a la quimioatracción ejercida por CRISP1, serían los mejores para un posterior uso en fertilización in vitro o ICSI (por el inglés Inyección Instracitoplasmática de Espermatozoide).
Fertilidad y anticoncepción, las dos caras de la misma moneda
En cuanto a las aplicaciones de CRISP1, también desde hace muchos años se estudia en el laboratorio la posibilidad de utilizarla para el desarrollo de un anticonceptivo.
“Siempre se pensó en anticoncepción masculina porque es lo que más falta en el mercado. Para los hombres sólo está disponible el preservativo ya que la vasectomía se considera una esterilización. Como la proteína CRISP1 bloquea CatSper, que es indispensable para la fertilidad, se podría pensar en modificarla de forma tal que, al unirse al espermatozoide, lo haga irreversiblemente y eso genere un método anticonceptivo aplicable a ambos sexos”, asegura Mariana Weigel Muñoz, becaria posdoctoral del CONICET en el IBYME.
En este sentido, Cuasnicú explica que hay escasas investigaciones sobre anticoncepción masculina y su objetivo es lograr un método farmacológico y no hormonal, que permita en el futuro un planeamiento familiar compartido. “Tener un eyaculado con espermatozoides bloqueados específicamente en su capacidad de reconocer al ovocito es una idea muy atractiva y es por eso que el epidídimo es ideal como target anticonceptivo. Cuanto más se sepa del proceso de fertilización, más conocimiento se podrá volcar a la fertilización asistida y al desarrollo de anticonceptivos masculinos, pero todavía falta. Es muy lindo trabajar con gametas porque es el inicio de la vida y es algo que nunca nos deja de sorprender, nos seguimos emocionando con cada experimento”, concluye.
Similitudes y diferencias con Gal-1
Además de su línea de investigación histórica en el estudio de CRISP1 en la interacción de gametas, el equipo de Cuasnicú recientemente publicó un trabajo en la revista The FASEB Journal en colaboración con Gabriel Rabinovich, investigador superior del CONICET en el IBYME, en el que analizaron la acción de otra proteína, Galectina 1 (Gal-1), en este proceso.
“Las galectinas, que son las proteínas con las que trabaja Rabinovich, y las CRISP tienen muchos puntos en común. Las dos son familias de proteínas secretorias y están presentes en el tracto femenino y masculino y en células inmunes. La idea de estudiar la participación de Gal-1 en la fertilización surgió porque las galectinas son proteínas unidoras de hidratos de carbonos y se sabe que la interacción proteína-azúcar cumple un rol muy importante en la interacción de gametas”, destaca Cuasnicú.
A pesar de las similitudes entre las CRISP1 y las Galectinas, los investigadores advierten que las galectinas son más ubicuas, mientras que las CRISP están principalmente en el aparato reproductor. Asimismo, explican que si bien al igual que CRISP1, Gal-1 también está presente en ambas gametas, la proteína Gal-1 del espermatozoide resulta relevante para la fertilización mientras que la presente en el cumulus no incide en los porcentajes de fertilización como lo hace CRISP1.
“Cuando los espermatozoides salen del testículo, su ADN queda comprimido de tal manera que no se puede leer. Todas las proteínas que el espermatozoide tiene están muy modificadas para que una sola pueda cumplir distintos roles. Una de esas modificaciones que se creían eran ‘decorados’ es muy importante para la función que estudiamos y es la glicosilación, un proceso en el que las proteínas se unen a los hidratos de carbono. Hay muchas proteínas ‘decoradas’ con hidratos de carbono, Gal-1 las organiza y les indica si tienen que modificarse o no en la función que tienen. Ese rol que tiene en muchos sistemas, en el espermatozoide es muy importante para que pueda expresar su capacidad de fertilizar”, agrega Gustavo Vasen, becario doctoral del CONICET.
En este sentido, Vasen agrega que es probable que Gal-1 actúe sobre un canal de potasio llamado Slo3 que es clave para la regulación tanto de la motilidad del espermatozoide como del potencial de membrana, es decir, la distribución de cargas en las membranas de las células. Este canal está ‘decorado’ con glicosilaciones, los animales que no lo tienen son infértiles.
Los científicos explican que las dificultades en la fertilización podrían revertirse, al menos parcialmente, si se agregan cualquiera de las dos proteínas para producir una “maduración artificial” del espermatozoide in vitro. Cuasnicú destaca que esto sería de gran utilidad para las personas que padecen Esterilidad Sin Causa Aparente (ESCA), es decir aquellas en que todo lo estudiado no explica su infertilidad, ya que algunos de estos casos podría deberse a la falta de estas proteínas en las gametas.
“Si bien los espermatozoides que no tienen CRISP1 o Gal-1 tienen menor capacidad fertilizante, los mecanismos últimos que llevan a dichas deficiencias son diferentes, ya que cada proteína regula un canal diferente. Dado que se apunta cada vez más a una medicina personalizada, la identificación de estas proteínas involucradas en el proceso de fertilización podría ayudar a brindar un tratamiento más específico a cada paciente”, concluye Débora Cohen, investigadora adjunta del CONICET en el IBYME.
Fuente: CONICET