|
C TELOPEPTIDO
Sinonimia: ICTP, ßCROSS
LAPS, CTX
Método: RIA, ELISA, quimioluminiscencia
Muestra:
Orina 24 hs, primera de la mañana u orina al azar, evitar la
exposición a la luz y al sol.
Para monitoreo es necesario recolectar la muestra siempre en los mismos
tiempos para que los datos sean comparables.
Plasma: ßCROSS LAPS.
Valor de referencia:
Orina: 126 +/- 38 µg /mmol creatinina
Plasma: ßCROSS LAPS
| HOMBRES |
Valor medio |
Rango |
| 30-50 años: |
300 pg/ml |
16-584 pg/ml |
| 51-70 años: |
304 pg/ml |
10-704 pg/ml |
| >70 años: |
394 pg/ml |
20-854 pg/ml |
| MUJERES |
Valor medio |
Rango |
| Premenopaúsicas |
299 pg/ml |
25-573 pg/ml |
| Postmenopaúsicas |
556 pg/ml |
104-1008 pg/ml |
Ventaja: Su dosaje no se ve afectado por la determinación
de creatinina, variaciones diurnas en la excreción de creatinina
urinaria, recolección de la muestra de orina.
Significado clínico:
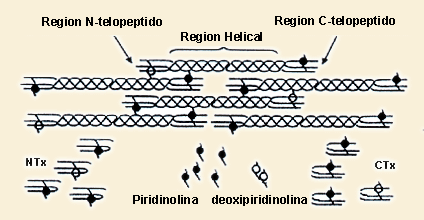
El CTX consiste en una secuencia peptídica de 26 residuos de aminoácidos
incluidos dentro de la cadena  1 del C telopéptido.
Generalmente los ensayos para su determinación están dirigidos
hacia una secuencia de 8 residuos de aminoácidos. 1 del C telopéptido.
Generalmente los ensayos para su determinación están dirigidos
hacia una secuencia de 8 residuos de aminoácidos.
En el C-telopéptido, la secuencia Asp-Gli es un sitio potencial
para una isomerización ß. Con el envejecimiento de los huesos, el acido  aspartico que se encuentra en los telopeptidos C-terminales se transforma en ß aspartico (ß-CTX). Estos asi denominados telopeptidos isomerizados son especificos de la degradacion del colageno tipo I propio de los huesos. Esto alteraría la estructura
espacial del octapéptido y como dicha reacción ocurre espontáneamente
en el tiempo está generalmente aceptado que dicha isomerización
se asocia con la edad de las proteínas y de los péptidos.
Aumenta con la edad del hueso y alcanza un equilibrio a los tres años
de mineralización del mismo. aspartico que se encuentra en los telopeptidos C-terminales se transforma en ß aspartico (ß-CTX). Estos asi denominados telopeptidos isomerizados son especificos de la degradacion del colageno tipo I propio de los huesos. Esto alteraría la estructura
espacial del octapéptido y como dicha reacción ocurre espontáneamente
en el tiempo está generalmente aceptado que dicha isomerización
se asocia con la edad de las proteínas y de los péptidos.
Aumenta con la edad del hueso y alcanza un equilibrio a los tres años
de mineralización del mismo.

Esto hace que el CTX pueda encontrarse en dos formas isoméricas
distintas:  o ß. Durante la resorción ósea, ambas formas
se liberan a circulación y se eliminan por orina. o ß. Durante la resorción ósea, ambas formas
se liberan a circulación y se eliminan por orina.
Los pequeños fragmentos de degradación del telopéptido
de colágeno tipo I son liberados al fluido extracelular durante
la resorción ósea. Estos fragmentos parecen ser específicos
de hueso ya que poseen el tipo de entrecruzamiento del colágeno
maduro tipo I de este origen, que no ocurre en el colágeno tipo
I de otras fuentes.
Existen dos tipos de regiones en el colágeno tipo I: N-telopéptidos
y C-telopéptidos.
Los N- telopéptidos o NTX o INTP se encuentran enriquecidos con
DPYR comparados con los ICTP (C-telopéptidos).
Ver actualización El Laboratorio en Osteoporosis
Tienen una variación circadiana con un máximo entre las
4-9 a.m. y valores mínimos a la tarde.
Utilidad clínica:
- Marcador de resorción ósea.
- Monitoreo de la terapia hormonal de reemplazo en mujeres postmenopáusicas.
(ß Cross Laps).
- Monitoreo de la terapia y curso de la enfermedad. Los ICTP son útiles
como indicadores de respuesta al tratamiento y predicción de
sobrevida en pacientes con osteolísis asociado con mieloma múltiple.
- Pronóstico en pacientes con artritis reumatoidea. Los ICTP
correlacionan positivamente con la severidad de la artritis reumatoidea.
Variables preanalíticas:
Aumentado:
Inmovilización, pubertad, embarazo, menopausia, post-fractura (permanecen
elevados 6 meses o más), reposo en cama prolongado.
Variables por enfermedad:
Aumentado:
Enfermedad de Paget, hipertiroidismo, metástasis óseas,
hiperparatiroidismo, mieloma múltiple, metástasis osteolíticas,
osteoporosis hiperresortivas primaria o secundaria.
Variables por drogas:
Disminuido:
Estrógenos, bifosfonatos, calcitonina.
Bibliografía:
1. Rafel Fonseca,1 , Michael C. Trendle, 1 , Traci Leong, 2 , Robert
A. Kyle, 1, Martin M. Oken, 3 , Neil E. Kay, 3 , Brian Van Ness 4 and
Philip R. Greipp 1 . Pronostic value of serum markers of bone metabolism
in untreated multiple myeloma patients. British Journal of haematology
109 (1), 24-29.
2. Aman s., Paimela L., Leirisalo-Repo M, Ristelli J. Kautiainen H., Helve
T., Hakala M. Predection of disease progression in early rheumatoid arthritis
by CRP. A comparative 3-year follow-up study. Rheumatology (Oxford) 2000
Sep:39 (9): 1009-13.
3. Paul D. Miller, MD, Daniel T. Baran, MD, John P. Bilezikian, MD, Susan
L. Greenspan, MD, Robert Lindsay, MBCHB, PHD, B. Lawrence Riggs, MD and
Nelson B. Watts, MD. Practical Clinical Application os Biochemical Markers
of Bone Turnover. Journal of Clinicla Densitometry; 1999, 2N°3: 323-342.
4. Robert H. Christenson. Biochemical Markers of Bone Metabolism: An Overview.
Clinical Biochemistry; 1997, 30 : 573-593.
5. Zeni S. ,Wittich A., Di Gregorio S. , Casco C., Oviedo A., Somoza J.,
Gómez Acotto C., Bagur A., González D., Portela M., Mautalén
C. Utilidad clínica de los marcadores de formación y resorción
ósea. Acta Bioquímica Clínica Latinoamericana. Vol
XXXV, N°1, 3-26;2001.
6. Lawrence G. Raiz. Physiology and Pathophysiology of Bone Remodeling.
Clinical Chemistry, Vol 45:8(B), 1353-1358; 1999.
|